
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
分析 A.泥浆和豆浆都是胶体,胶体遇到电解质溶液发生聚沉现象;
B.“煤改气”“煤改电”等清洁燃料改造工程可以减少二氧化硫、氮氧化物和可吸入颗粒物的含量;
C.聚乙烯塑料难以降解,用二氧化碳等原料合成聚碳酸酯类可降解,从而减少了白色污染;
D.焰色反应为物理变化.
解答 解:A.黄河水中的泥浆和豆浆都是胶体,胶体遇电解质溶液发生聚沉,所以黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质,故A正确;
B.“煤改气”“煤改电”等清洁燃料改造工程减少了二氧化硫、氮氧化物和可吸入颗粒物,故有利于减少雾霾天气,故B正确;
C.白色污染的主要来源为聚乙烯材料,难以降解,但利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染,故C正确;
D.焰色反应是指某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应,是某些金属元素的物理性质,故D错误;
故选D.
点评 本题考查较为综合,涉及焰色反应、胶体的性质、环境污染及治理等知识,题目浓度不大,注意掌握常见物质组成、结构与性质,试题侧重对基础知识的巩固,培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
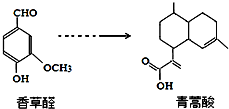 下列叙述正确的是( )
下列叙述正确的是( )| A. | 青蒿酸分子能在NaOH溶液中发生水解反应 | |
| B. | 在一定条件下,香草醛分子最多有16个原子共面 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 用FeCl3溶液或NaHCO3溶液都可以鉴别香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OCH2CH2CH3 | B. | CH3CH(OH)CH2CH3 | C. | (CH3)2CHCH2OH | D. | CH3CH2CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q与Y组成的常见物质是一种两性物质,结构中含有共价键 | |
| B. | 已知WRZQ3溶液呈酸性,若将WRZQ3固体溶于水,能促进水的电离 | |
| C. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 | |
| D. | 元素T、Q、W、Y的原子半径大小为T<Q<Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 若①②③④四种溶液等体积混合,混合液pH=7,则混合液中c(NH4+)=c(CH3COO-) | |
| B. | ①④两溶液等体积混合,混合液中c(H+)>c(OH-) | |
| C. | ①③溶液中水的电离程度相等 | |
| D. | V1L②和V2L④溶液混合后溶液pH=9,则V1=$\frac{11}{9}$V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
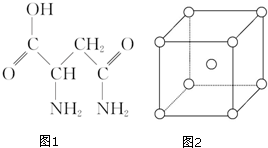 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的含氧酸一定是强酸 | |
| B. | 原子半径:X>Z | |
| C. | 气态氢化物热稳定性:W>X | |
| D. | W、X与H形成化合物的水溶液可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com