
| ||
| ||
| ||
| ||
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、使阴、阳离子结合成化合物的静电作用叫做离子键 |
| B、含共价键的化合物不一定是共价化合物 |
| C、化合物中只要含有离子键就一定属于离子化合物 |
| D、金属元素与非金属元素相化合时一定形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷(乙烯):KMnO4酸性溶液,洗气 |
| B、乙醇(乙酸):碱石灰,蒸馏 |
| C、甲苯(苯酚):浓溴水,过滤 |
| D、溴乙烷(乙醇):苯,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].查看答案和解析>>
科目:高中化学 来源: 题型:
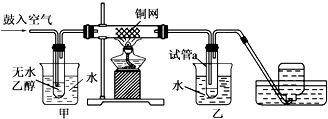
查看答案和解析>>
科目:高中化学 来源: 题型:
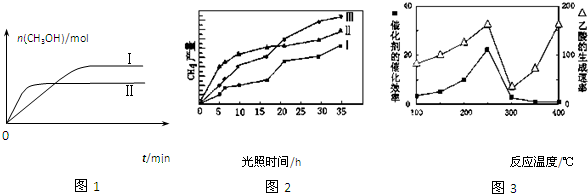
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
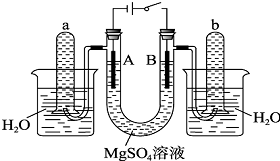 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com