
一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
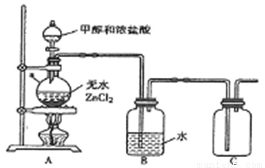
①仪器a的名称为___________。
②无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为_____________。
③装置B的主要作用是_____________。
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。

①乙组同学的实验装置中,依次连接的合理顺序为A→B→_____→_____→_____。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞先后加入两种试剂,观察实验现象。分液漏斗中先后加入的试剂是_______________。
③能证明CH3Cl中含有氯元素的实验现象是____________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3Cl中的卤素原子。相关数据如下表:
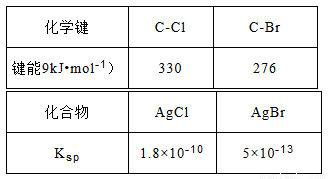
将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:2016-2017学年河北省高一下学期3月月考化学试卷(解析版) 题型:选择题
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
A.MgF2 B.MgCl2 C.CaCl2 D.CaBr2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差是8,A原子的最外层电子数是其次外层电子数的3倍,在同周期主族元素中B原子的原子半径最大。下列说法正确的是
A. 气态氢化物的热稳定性:A<C
B. 元素A与B只能形成一种化合物
C. 元素B与D形成的化合物是离子化合物
D. 最高价氧化物对应的水化物的酸性:C>D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高二下学期开学考试化学试卷(解析版) 题型:选择题
有一未知的无色溶液,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、SO42-,现取两份100mL溶液进行如下实验: ①第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。②第二份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。以下推测不正确的是
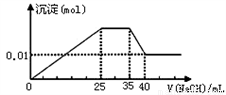
A. 原溶液一定不存在Cu2+
B. 不能确定原溶液是否含有K+
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+) ∶n(Al3+)∶n( NH4+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高二下学期开学考试化学试卷(解析版) 题型:选择题
对反应A + 3B = 2C来说,下列反应速率中最快的是
A. υ(A)=0.3 mol/(L·min) B. υ(B)=0.6 mol/(L·min)
C. υ(C)=0.7 mol/(L·min) D. υ(A)=0.005 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二3月月考化学试卷(解析版) 题型:选择题
0.1某烃完全燃烧时生成30.8gCO2和12.6gH2O,且能使酸性高锰酸钾溶液褪色,若其结构中只含有两个-CH3,则该物质的结构(考虑顺反异构)最多有
A. 8种 B. 9种 C. 10种 D. 11种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二3月月考化学试卷(解析版) 题型:选择题
下列相关说法中,正确的是
A. 实验室制乙烯,加热时要注意使温度缓慢上升到170℃
B. 实验室制乙块时可用饱和食盐水代替水,以加快反应速率
C. 制取硝基苯时,温度计应放在反应混合液中且温度应控制在50~60℃
D. 将一卤乙烷和NaOH乙醇溶液混合共热后,向混合液加硝酸酸化、再加AgNO3,若出现谈黄色沉淀,可说明该卤代烃为溴乙烷
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省淄博市高一3月月考化学试卷(解析版) 题型:选择题
香烟烟雾中含有CO、CO2、SO2、H2O等气体。用a无水硫酸铜、b澄清石灰水、c红热氧化铜、d生石灰、e品红溶液等可将其一一检出,检出的正确顺序是
A.混合气→a→e→e→b→d→c
B.混合气→c→d→e→e→a
C.混合气→a→e→b→a→d→c
D.混合气→b→e→a→d→c
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三毕业班联考(一)化学试卷(解析版) 题型:简答题
以含有Ca2+、Mg2+、Clˉ、SO42ˉ、Brˉ 等离子的卤水为主要原料可制备金属镁和溴。流程如下:
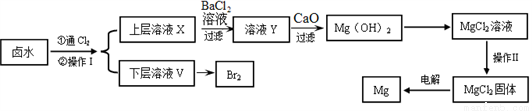
(1)操作Ⅰ的名称是______,所用主要玻璃仪器的名称是_________、_________;需要选择的试剂是____________(填序号)。
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式__________________________________。
(3)证明SO42ˉ完全沉淀的方法是______________________________。
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由下表中数据可知,理论上应控制pH范围是__________。
开始沉淀时 | 沉淀完全时 | |
Mg2+ | pH=9.6 | pH=11.0 |
Ca2+ | pH=12.2 | c(OH-) =1.8mol/L |
(5)操作Ⅱ用下图所示操作______________实现(填“能”或“不能”)。原因是______________________________(用化学方程式解释)。

(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是___________________________(用离子方程式表示)。
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com