
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
分析 A、根据公式v=$\frac{△c}{△t}$计算三氧化硫表示的反应速率,根据化学反应速率之比等于系数之比计算氧气的平均速率;
B、平衡常数只受温度的影响;
C、根据极限转化的思想,向容器中充入4mol SO3,相当于投入4mol二氧化硫和2mol氧气;
D、根据压强对化学反应速率的影响知识来回答判断.
解答 解:A、三氧化硫表示的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{{t}_{1}}$=$\frac{0.3}{{t}_{1}}$mol•L-1•s-1,化学反应速率之比等于系数之比,氧气的平均速率为$\frac{1}{2}$×$\frac{0.3}{{t}_{1}}$mol•L-1•s-1,故A错误;
B、2SO2(g)+O2(g)?2SO3(g)
初起浓度:1 0.5 0
变化浓度:0.9 0.45 0.9
平衡浓度:0.1 0.05 0.9
所以K=$\frac{0.{9}^{2}}{0.{1}^{2}×0.05}$=1.62×103,故B错误;
C、相同温度下,起始时向容器中充入4mol SO3,生成物描述产率,而不是转化率,故C错误;
D、温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3,增大了压强,平衡正向移动,三氧化硫的物质的量增加,所以反应达到新平衡时SO3转化率升高,故D正确.
故选D.
点评 本题考查学生化学反应速率的计算、化学平衡的移动等方面的知识,注意三行式在解题中的应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题

 (或
(或
 );
);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
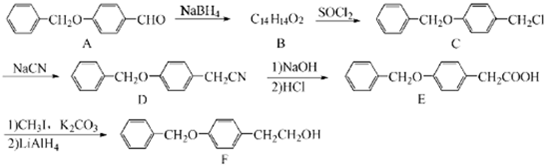
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 选项 | X | Y |
| A | Na2CO3 | NaHCO3 |
| B | Al(OH)3 | Al2O3 |
| C | FeCl3 | FeCl2 |
| D | CuSO4 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
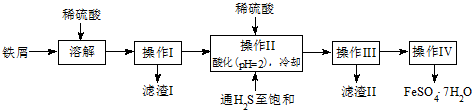
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+>O2->H+ | B. | 与水反应的剧烈程度:K>Na>Mg>Ca | ||
| C. | 熔点:CO2>SiO2>Na2O>SO3 | D. | 还原性:PH3>H2S>HCl>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com