
| A、360mg |
| B、3.6g |
| C、0.36g |
| D、2.5×10-4mol |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
| A、甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol |
| B、光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、聚乙烯、蛋白质和纤维素都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝与过量的氨水反应:Al3++4OH-═AlO2-+2H2O | ||||
| B、除去铁粉中的铝:2Al+2NaOH═2NaAlO2+H2↑ | ||||
C、实验室制取Cl2的离子方程式:MnO2+4HCl(浓)
| ||||
D、浓硫酸与铜的反应:Cu+2H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b电极与电源的正极相连接 |
| B、电解过程中,水既是氧化剂又是还原剂 |
| C、a极附近溶液的pH变小 |
| D、b极的电极反应式是4OH--4e-═O2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性FeSO4溶液中加入双氧水:2Fe2++H2O2+2H+═2Fe3++2H2O | ||||
B、电解饱和MgCl2溶液:2H2O+2Cl-
| ||||
| C、向Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | ||||
| D、向饱和碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
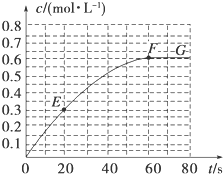 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=-a kJ?mol-1.其中B的物质的量浓度随时间变化如图所示.
298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=-a kJ?mol-1.其中B的物质的量浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com