
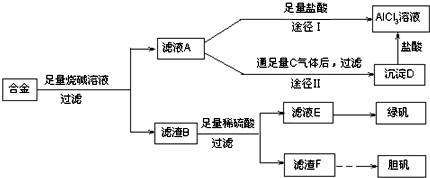


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
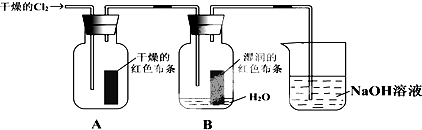
查看答案和解析>>
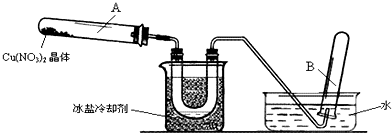
科目:高中化学 来源: 题型:
| 实 验 操 作 步 骤 | 现 象 |
| 步骤1:观察溶液. | 溶液呈暗蓝色 |
| 步骤2:取少量稀释后溶液,滴加酸性KMnO4溶液. | 紫色不消失 |
| 步骤3:取少量稀释后溶液,滴加KSCN溶液. | 变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
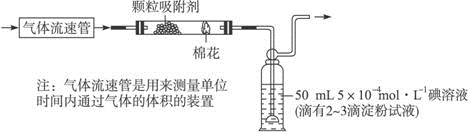

查看答案和解析>>
科目:高中化学 来源: 题型:
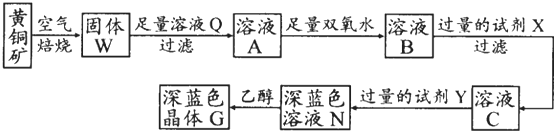
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| Ksp | 8.0×1016 | 2.2×1022 | 4.0×1038 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①④ | B、只有③ |
| C、只有②③ | D、只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
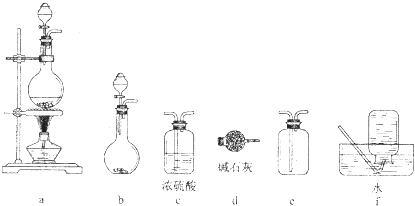
| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com