
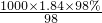 mol/L=18.4mol/L,令配制250mL1.0mol/LH2SO4溶液,需用98%的浓硫酸体积为V,根据稀释定律,稀释前后溶质的物质的量不变,则18.4mol/L×V=250mL×1.0mol/L,解得V=13.59mL.
mol/L=18.4mol/L,令配制250mL1.0mol/LH2SO4溶液,需用98%的浓硫酸体积为V,根据稀释定律,稀释前后溶质的物质的量不变,则18.4mol/L×V=250mL×1.0mol/L,解得V=13.59mL.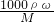 计算98%的浓硫酸溶液的物质的量浓度,再利用稀释定律计算需要浓硫酸的体积;
计算98%的浓硫酸溶液的物质的量浓度,再利用稀释定律计算需要浓硫酸的体积;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2AlN+3CO
2AlN+3CO
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com