
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
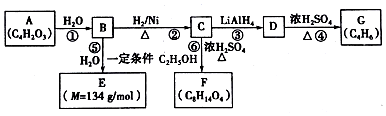
分析 某有机物A,其分子式为C5H10O2.不饱和度为1,A不能使溴的CCl4溶液褪色,说明没有碳碳双键或碳碳三键,再根据1mol A与足量的钠反应可生成标况下22.4L的H2,说明分子中含有1个羟基、1个羧基,可以看成羟基取代戊酸上的氢原子,注意同一个碳原子上只连有一个官能团;
解答 解:某有机物A,其分子式为C5H10O2.不饱和度为1,A不能使溴的CCl4溶液褪色,说明没有碳碳双键或碳碳三键,再根据1mol A与足量的钠反应可生成标况下22.4L的H2,说明分子中含有1个羟基、1个羧基,戊酸的同分异构体有:HOOCCH2CH2CH2CH3,HOOCCH(CH3)CH2CH3,HOOCCH2CH(CH3)CH3,HOOCC(CH3)3,用羟基取代戊酸上的氢原子,且同一个碳原子上只连有一个官能团的异构体分别有:3种、3种、2种、1种,故选A.
点评 本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,侧重分析与推断能力的考查,注意羧酸、醇、烯烃的性质,题目难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
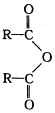 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)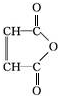 .
. .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
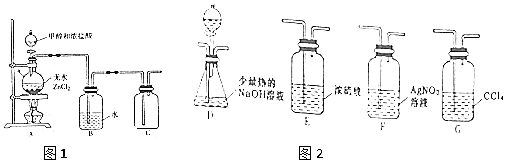
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
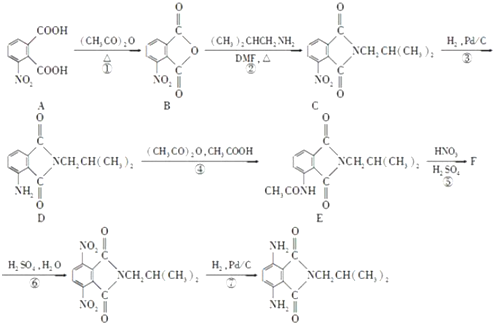
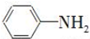 )有还原性,易被氧化;
)有还原性,易被氧化;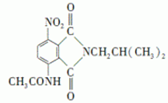 .
.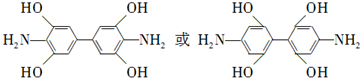 .
.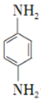 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
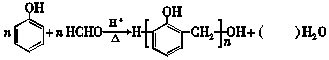
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下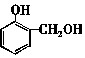 比 比 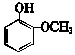 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是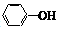 和HCHO 和HCHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com