
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
科目:高中化学 来源:不详 题型:单选题
| A.氢原子的能量比氢分子的能量低 |
| B.两个氢原子结合成一个氢分子时放出435.7kJ能量 |
| C.1mol氢分子分解成2mol氢原子要吸收435.7kJ能量 |
| D.2mol氢原子结合1mol氢分子成要吸收435.7kJ能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
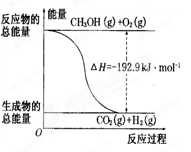
| A.CH30H转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
| C.根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g)△H>一192.9 kJ/mol |
| D.反应②的能量变化如图所示 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1 CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1 CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。 CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol| A.升高温度,可使①②反应速率均加快 |
| B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol |
| D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com