
化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.Na2O2、K2O2可用作潜水艇内的氧气来源
C.Al2O3的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持50~60 ℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
花青苷是引起花果呈现颜色的一种花色素,广泛存在于植物中。它的主要结构在不同pH条件下有
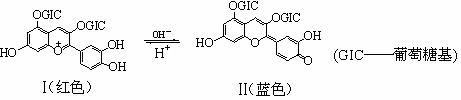
以下存在形式:
下列有关花青苷说法不正确的是
A.花青苷可作为一种酸碱指示剂 B.I和II中均含有二个苯环
C.I和II中除了葡萄糖基中碳原子外,其它所有碳原子一定共平面
D.I和II均能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是
A.0.5mol·L-1 Na2SO4溶液中所含的Na+数为NA
B.常温常压下,4g氦气所含有的质子数为4NA
C.1molCl2与足量Fe反应,转移的电子数为3NA
D.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲肼”和四氧化二氮作为液体燃料。
⑴已知偏二甲肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮。则偏二甲肼的分子式为______;30g偏二甲肼中所含的氢原子数与标准状况下 L CH4中所含的氢原子数相等。
⑵N2O4的摩尔质量是 ,等质量的N2O4和NO2中所含的原子数之比为 。
⑶在发动机中物质的量之比为1∶2偏二甲肼和四氧化二氮恰好完全反应,生成CO2、H2O、N2,写出该反应的化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不能按如图所示关系一步完成转化的是( )
| A | B | C | D | |
| a | CO2 | H2SO4 | Al(OH)3 | HNO3 |
| b | Na2CO3 | SO2 | NaAlO2 | NO |
| c | NaHCO3 | SO3 | Al2O3 | NO2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O ,工艺流程如下(部分操作和条件略):
,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是____________________________________。
(2)将MnO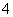 氧化Fe2+的离子方程式补充完整:
氧化Fe2+的离子方程式补充完整:
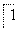 MnO
MnO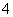 +
+ Fe2++
Fe2++ ________=
________=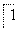 Mn2++
Mn2++ Fe3++
Fe3++ ________。
________。
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时[来源:学.科.网] | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:________。
(4)己知:一定条件下,MnO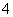 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是__________。
② Ⅳ 中加入MnSO4的目的是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮、氧、硫、氯是四种重要的非金属元素,下列有关说法中正确的是( )
A.NO在常温下能与空气中的氧气反应
B.氮、硫的最高价氧化物对应水化物的溶液均具有很强的氧化性
C.用石墨作电极电解物质的量浓度相等的硫化钠 、氯化钠混合溶液,阳极上析出的物质依次为Cl2、S、O2
、氯化钠混合溶液,阳极上析出的物质依次为Cl2、S、O2
D.四种元素的单质中化学性质最稳定的是N2,其次是硫
查看答案和解析>>
科目:高中化学 来源: 题型:
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1溴丁烷的反应如下:
NaBr+H2SO4===HBr+NaHSO4 ①
R—OH+HBrR—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1溴丁烷 | |
| 密度/(g·cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)在溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
A.圆底烧瓶 B.量筒
C.锥形瓶 D.漏斗
(2)溴代烃的水溶性________(填“大于”“等于”或“小于”)相应的醇,其原因是__________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
A.NaI B.NaOH
C.NaHSO3 D.KCl
(6)在制备溴乙烷时,采用边反应边蒸馏产物的方法,其有利于________;但在制备1溴丁烷时却不能边反应边蒸馏,其原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com