
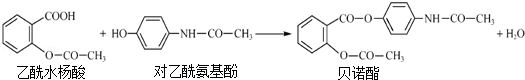
| A. | 1mol贝诺酯分子可与7molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
分析 A.贝诺酯中只有苯环能和氢气在一定条件下发生加成反应;
B.乙酰水杨酸中不含酚羟基、对乙酰氨基酚含有酚羟基,酚能与氯化铁溶液发生显色反应;
C.贝诺酯与NaOH溶液共热知,该物质水解生成邻羟基苯甲酸、乙酸、对乙酰氨基酚钠;
D.羧基能和碳酸氢钠反应,酚羟基和碳酸氢钠不反应.
解答 解:A.贝诺酯中只有苯环能和氢气在一定条件下发生加成反应,所以1mol贝诺酯分子可与6molH2完全反应,故A错误;
B.乙酰水杨酸中不含酚羟基、对乙酰氨基酚含有酚羟基,酚能与氯化铁溶液发生显色反应,所以可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚,故B正确;
C.贝诺酯与NaOH溶液共热知,该物质水解生成邻羟基苯甲酸钠、乙酸钠、对乙酰氨基酚钠,故C错误;
D.羧基能和碳酸氢钠反应,酚羟基和碳酸氢钠不反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,涉及酯、酚、羧酸的性质,注意贝诺酯中酯基、肽键不能和氢气发生加成反应,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
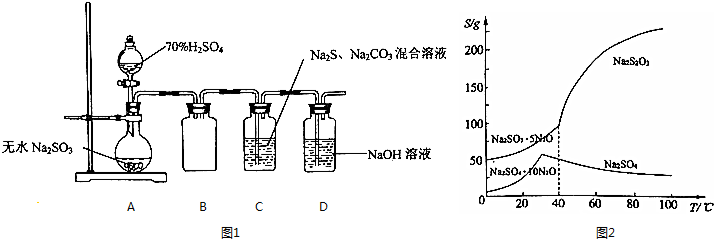
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
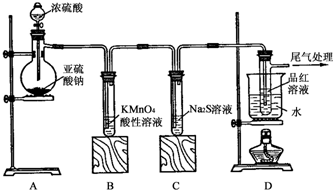
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
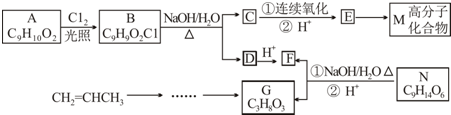
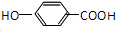 .
. .
.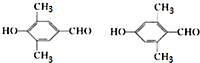 .
.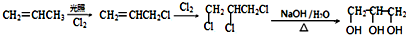 . (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
. (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com