
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
分析 X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04,X、Y最高正化合价分别为+6、+7,则X为S元素,Y为Cl,R、M同主族,R与冷水即可反应,M与热水反应缓慢,金属性R>M,R为Na、M为Li,结合元素周期律解答.
解答 解:X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04,X、Y最高正化合价分别为+6、+7,则X为S元素,Y为Cl,R、M同主族,R与冷水即可反应,M与热水反应缓慢,金属性R>M,R为Na、M为Li.
A.X为S元素,Y为Cl,同周期随原子序数增大,原子半径减小,故原子半径X>Y,故A正确;
B.非金属性S<Cl,故氢化物稳定性H2S<HCl,故B错误;
C.R、M同主族,R与冷水即可反应,M与热水反应缓慢,金属性R>M,同一主族元素,元素金属性随着原子序数增大而增强,故质子数R>M,故C错误;
D.R为Na、M为Li,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性NaOH>LiOH,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | AgCl悬浊液中存在平衡:AgCl(s)═Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) | |
| D. | 硬水中含有较多的Ca2+?Mg2+?HCO3-、SO42-,加热煮沸可以完全除去其中的Ca2+?Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  证明装置的气密性良好 | |
| B. | 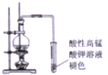 证明乙醇与浓H2SO4共热生成了大量乙烯 | |
| C. |  证明SO2有还原性 | |
| D. |  用饱和食盐水与CaC2制备并收集C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X离子的氧化性大于Y离子 | B. | W的气态氢化物的稳定性比Z的弱 | ||
| C. | 含Y的盐溶液一定显酸性 | D. | X离子的半径小于W离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com