
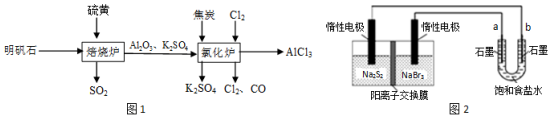
分析 (1)亚硫酸放置在空气中被氧化为硫酸,硫酸为强酸,酸性增大;
(2)焦炭能与氧气反应,使生成物氧气的浓度减小,且焦炭与氧气的反应为放热反应,温度升高,均有利于反应的正向移动;
(3)①用惰性电极电解饱和食盐水,由氯离子和水中的氢离子放电得到氯气和氢气;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液阳离子向正极移动;由反应2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{\;}$Na2S4+3NaBr可知,左侧S22-放电生成S42-.
解答 解:(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸,2H2SO3+O2=2H2SO4,使溶液中的c(H+)增大,pH减小;
故答案为:酸雨中的弱酸亚硫酸被氧化为强酸硫酸,2H2SO3+O2=2H2SO4,使溶液中的c(H+)增大,pH减小;
(2)焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)为吸热反应,温度升高,导致平衡向正反应方向移动;
故答案为:焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动;
(3)①用惰性电极电解饱和食盐水,氯离子放电生成氯气,水中的氢离子放电生成氢气,则离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液阳离子向正极移动;由反应2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{\;}$Na2S4+3NaBr可知,左侧S22-放电生成S42-;
故答案为:右槽;2S22-?2e-=S42-.
点评 本题考查化学平衡移动、元素化合物性质、原电池、电解池、实验方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
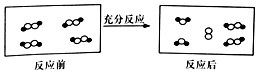 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )| A. | 属于化合反应 | B. | 属于置换反应 | ||
| C. | 属于氧化还原反应 | D. | 属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
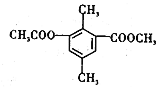
| A. | 分子中不同化学环境的氢共有4种 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 能发生取代、消去、加成和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
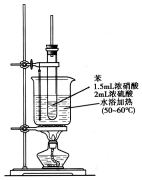 纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.
纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.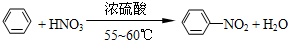 .
.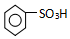 ),导致硝基苯的产率下降.写出发生副反应的化学方程式
),导致硝基苯的产率下降.写出发生副反应的化学方程式 +H2SO4(浓)$\stackrel{△}{→}$
+H2SO4(浓)$\stackrel{△}{→}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
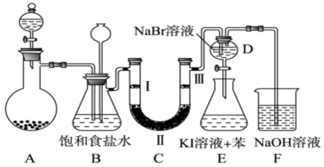
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、萃取、分液 | D. | 萃取、蒸馏、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com