
分析 (1)盐酸溶液酸性大于次氯酸,向氯水中加入几滴碳酸钠溶液和盐酸发生反应生成二氧化碳,次氯酸不反应,氯气和水反应的化学平衡正向进行;
(2)氯水中存在次氯酸,次氯酸见光分解生成氯化氢和氧气,氯水中平衡正向进行,HCl浓度增大,次氯酸浓度减小;
解答 解:(1)盐酸溶液酸性大于次氯酸,向氯水中加入几滴碳酸钠溶液,少量碳酸钠和盐酸发生反应生成二氧化碳,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,次氯酸不反应,氯气和水反应的化学平衡正向进行,HCl浓度减小,HClO浓度增大.
故答案为:变小,变大,CO32-+2H+=H2O+CO2↑;
(2)氯水中存在次氯酸,次氯酸见光分解生成氯化氢和氧气,氯水中Cl2+H2O?HCl+HClO,平衡正向进行,HCl浓度增大,次氯酸分解浓度减小;
故答案为:变大、变小,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查了弱电解质电离平衡,化学平衡的影响因素分析,主要是酸性强弱的理解应用和离子方程式的书写,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 14C的原子结构示意图: | ||
| C. | 聚氯乙烯的结构简式: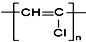 | D. | 丙烷分子的球棍模型示意图: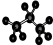 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色,证明氧化性:H2O2比Fe3+强 | |
| D. | 在2Na+2C+2NH3=2NaCN+3H2↑反应中的还原剂为C和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
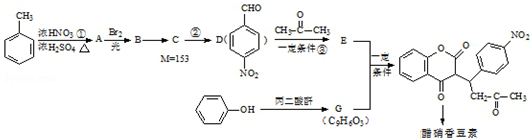
 +H2O
+H2O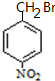 G
G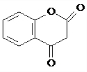
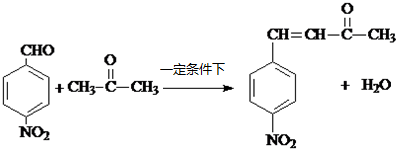
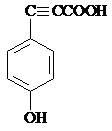 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 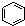 和 和 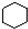 均是芳香烃, 均是芳香烃,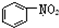 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 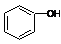 和 和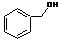 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com