
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
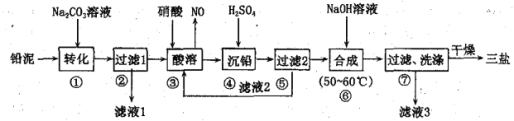
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题
(1)步骤①转化的目的是将PbSO4转化为PbCO3,反应的离子方程式为___________________。
(2)滤液3中的主要溶质为_____________(填化学式)。
(3)步骤③酸溶时,铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________________。
(4)滤液2中可循环利用的溶质为___________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)为___________mol·L-1
(5)步骤⑥合成三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.50 t,假设铅泥中的铅元素有80.00%转化为三盐,则铅泥中铅元素的质量分数为_____。[已知:三盐(3PbO·PbSO4·H2O)的相对分子质量为990,注意保留正确的有效数字]
【答案】CO32-+PbSO4=SO42-+PbCO3 Na2SO4 3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O HNO3 1.0×10-3 4 PbSO4+6NaOH![]() 3Na2SO4+3PbOPbSO4H2O+2H2O 51.75%
3Na2SO4+3PbOPbSO4H2O+2H2O 51.75%
【解析】
以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐:向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,![]() ,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
(1)由题可知,碳酸铅的Ksp小于硫酸铅,故加入碳酸钠的目的是将硫酸铅转化为碳酸铅,属于沉淀的转化,反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
(2)根据元素守恒,故可知滤液3的主要溶质是![]() ;
;
答案为:![]() ;
;
(3)铅与硝酸反应生成![]() 和
和![]() ,根据氧化还原反应规律配平即可,
,根据氧化还原反应规律配平即可,![]() ;
;
答案为:![]() ;
;
(4)![]() 、
、![]() 和
和![]() 在可以在硝酸的作用下生成
在可以在硝酸的作用下生成![]() ,而
,而![]() 可以在稀硫酸的作用下生成
可以在稀硫酸的作用下生成![]() 、
、![]() ,其中
,其中![]() 可以重复使用;由于
可以重复使用;由于![]() ,而
,而![]() ,则可算出
,则可算出 ;
;
故答案为:![]() ;
;![]() ;
;
(5)步骤⑥参与反应的物质为:![]() 和
和![]() ,该反应的方程式为:
,该反应的方程式为:![]() ,若得到纯净干燥的三盐49.5t,可算出含铅的质量为
,若得到纯净干燥的三盐49.5t,可算出含铅的质量为![]() 。设铅泥中含铅的质量分数为
。设铅泥中含铅的质量分数为![]() ,则100t铅泥中铅元素为100
,则100t铅泥中铅元素为100![]() ,而铅泥中的铅元素有80%转化为三盐,有41.4t,即
,而铅泥中的铅元素有80%转化为三盐,有41.4t,即![]() ,解得
,解得![]() ;
;
故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】将 38.4g 铜与适量浓硝酸恰好反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如下图所示:

下列有关判断正确的是( )
A. 若浓硝酸体积为 200mL,则其物质的量浓度为 11mol/L
B. NO、NO2、N2O4 和 NaOH 溶液反应时, NO2、N2O4 仅作还原剂
C. 生成 0.2 mol NaNO3 和 0.8 mol NaNO2
D. 硝酸在反应中仅体现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法
A.①⑤⑥B.②③④C.③⑤⑥D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.12.4 g白磷(P4)中所含的P-P键数目为0.6 NA
B.40 g SiC晶体中含有SiC分子的数目为NA个
C.1 mol麦芽糖完全水解后产生的葡萄糖分子数目为NA
D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
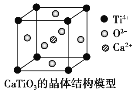
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②④⑥B.①②③C.③⑤⑧D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lg c(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
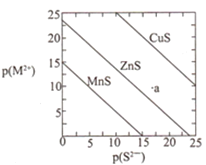
A.a点无ZnS沉淀生成
B.可用MnS除去MnCl2溶液中混有的少量ZnCl2
C.CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=10-20
D.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)![]() SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com