
| A. | 苯乙烯使溴水褪色;加成反应 | |
| B. | 乙烯水化生成乙醇;取代反应 | |
| C. | 乙醇与CuO加热反应生成乙醛;氧化反应 | |
| D. | 无水乙醇与浓硫酸加热到170℃制取乙烯;消去反应 |
分析 A.苯乙烯中含碳碳双键;
B.乙烯中含碳碳双键;
C.乙醇中含-OH,具有还原性,可被氧化生成醛;
D.乙醇转化为乙烯,-OH转化为碳碳双键.
解答 解:A.苯乙烯中含碳碳双键,与溴水可发生加成反应,故A正确;
B.乙烯中含碳碳双键,可与水发生加成反应生成乙醇,故B错误;
C.乙醇中含-OH,则乙醇与CuO加热发生氧化反应生成乙醛,故C正确;
D.乙醇转化为乙烯,-OH转化为碳碳双键,可知无水乙醇与浓硫酸加热到170℃制取乙烯,其反应类型为消去反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答的关键,侧重烯烃、醇性质的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
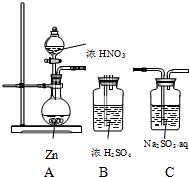 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:| 步骤 | 现象 | 结论 |
| 取少量C中反应后的溶液 置于试管中, 先加入盐酸溶液酸化,再加入 氯化钡溶液 | 有白色沉淀产生 | NO2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
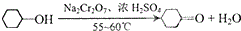 实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):| 物质 | 沸点( ) | 密度(g.cm-3,20) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水和乙醚 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水,能溶于乙醚 |
| 水 | 100.0 | 0.9982 |
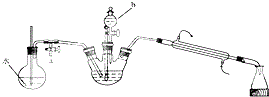
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入5.6g 铁粉充分反应后,溶液红色褪去 | |
| B. | 加入40mL水充分振荡后,静置,溶液红色变浅 | |
| C. | 加入10g Fe2(SO4)3固体充分反应后,溶液红色明显加深 | |
| D. | 加入20mL 0.001 mol/L KSCN溶液充分反应后,溶液红色明显变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
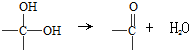
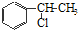 、
、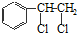 等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去
等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去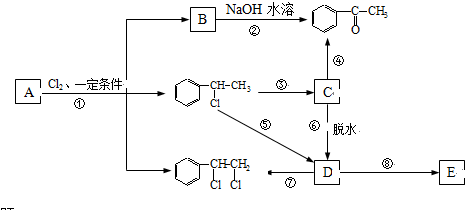
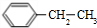 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$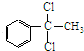 +2HCl,该反应类型为取代反应;
+2HCl,该反应类型为取代反应;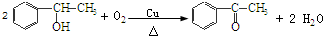 ,该反应类型为氧化反应;
,该反应类型为氧化反应;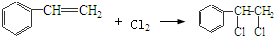 ,该反应类型为加成反应;
,该反应类型为加成反应;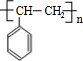 ;
;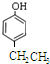 、
、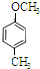 、
、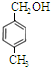 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的球棍模型为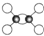 | |
| B. | H2O2的电子式为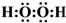 | |
| C. | 甲烷的结构式为CH4 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com