
| A、I- |
| B、N203 |
| C、Fe3+ |
| D、SiO2 |
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O | ||||
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O | ||||
D、用惰性电极电解MgCl2溶液:2H2O+2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 2.0 mol?L-1 NH4Cl溶液中含有NH4+的数目为0.2NA |
| B、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA |
| C、标准状况下,2.24L庚烷含有的分子数为0.1NA |
| D、常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
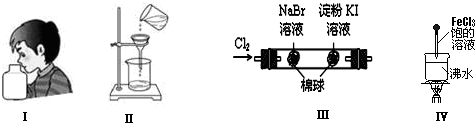
| A、实验Ⅰ:闻气味 |
| B、实验Ⅱ:过滤 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性:Cl2>Br2>I2 |
| D、实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na-K合金常温下呈液态,可做核反应堆的导热剂 |
| B、Na2O和Na2O2其阴阳离子个数比相等,Na2O在空气中加热会变成淡黄色的Na2O2 |
| C、Na2CO3和NaHCO3的水溶液均显碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,其PH前者大 |
| D、Na2CO3和NaHCO3两固体可用加热法鉴别,Na2CO3和NaHCO3两溶液可滴加Ba(OH)2溶液来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(X2)=0.15 mol/L |
| B、c(Y2)=0.9 mol/L |
| C、c(Z2)=0.3 mol/L |
| D、c(Q2)=0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com