
| A.无水CuSO4 | B.CuO | C.Cu(OH)2 | D.CuSO4?5H2O |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
(1)M溶液可能是 (填序号)。
A.KNO3溶液 B. Ba(OH)2溶液 C.H2SO4溶液
D. NaCl溶液 E.CuSO4溶液
(2)X为电源 极,m点的现象 。
(3)C极的电极反应式为 。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶 液的pH=1, 则乙池中C极析出的固体质量为 g。
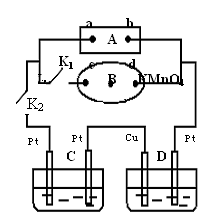 (5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为 。
(5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com