
【题目】某羧酸酯的分子式为C8H14O6,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,且1mol该羧酸能与足量的钠反应放出22.4L(标准状况)H2,下列说法错误的是( )
A. 该醇是乙二醇B. 该羧酸有3种同分异构体
C. 该羧酸含有的官能团是羟基和羧基D. 该羧酸的分子式是C3H6O3
【答案】B
【解析】
C8H14O6的不饱和度为:![]() =2,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,说明该酯中含有2个酯基,生成的羧酸含有1个-COOH,生成的醇含有2个-OH;1mol该羧酸能与足量的钠反应放出22.4LH2(标准状况),氢气的物质的量为1mol,生成1mol氢气需要2个羟基,而该羧酸中只含有1个羧基,则其分子中还含有1个羟基;生成的含有2个羟基的醇为常见醇,应该为乙二醇,该羧酸的分子式为C3H6O3,据此进行解答。
=2,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,说明该酯中含有2个酯基,生成的羧酸含有1个-COOH,生成的醇含有2个-OH;1mol该羧酸能与足量的钠反应放出22.4LH2(标准状况),氢气的物质的量为1mol,生成1mol氢气需要2个羟基,而该羧酸中只含有1个羧基,则其分子中还含有1个羟基;生成的含有2个羟基的醇为常见醇,应该为乙二醇,该羧酸的分子式为C3H6O3,据此进行解答。
A.根据分析可知,该醇是乙二醇,故A正确;
B.该羧酸的分子式为C3H6O3,其中属于含有1个羧基和1个羟基的同分异构体有2种,含有1个醛基、2个羟基的同分异构体有2种,还可以为酯类物质,所以其同分异构体大于4种,故B错误;
C.根据分析可知:该羧酸的官能团含有羟基和羧基,故C正确;
D.该的分子式是C3H6O3,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )
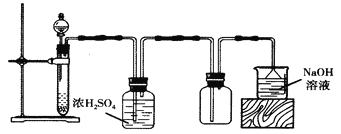
A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C. 以浓氨水、生石灰为原料,制备NH3
D. 以Cu、稀硝酸为原料,制备NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) ![]() xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)反应达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=___________。
(2)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是__ (填写字母序号)。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入__________(填A或B)________mol(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图(部分产物未列出),A是一种金属单质,D是一种非金属固体单质。
请回答下列问题:

(1)A、C的化学式分别为A_________,C_________;
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是_____;
A.C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4═FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:____________;
(4)若反应F+D→E转移电子数为6.02×1023,则消耗D的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图所示的装置实现“路线图”中的部分转化,下列叙述错误的是( )
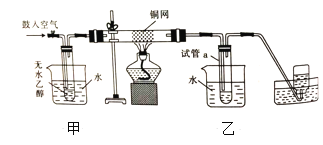
A. 铜网表面乙醇发生氧化反应
B. 甲、乙烧杯中的水均起冷却作用
C. 试管a收集的液体中至少有两种有机物
D. 实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。已知:Ksp(ZnS)=3×10-25,下列有关说法正确的是
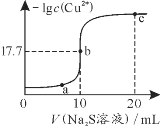
A.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
B.a、b、c三点对应的溶液中,水的电离程度最小的为b点
C.c点溶液中c(Cu2+)=10-34.4 mol·L-1
D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、M、N、O、P,原子序数逐渐增大,其中X、Y、Z、M、N为短周期元素,而X、Y、Z、M处于同周期的P区,且未成对电子数之比为1:2:3:2;N与Z同族。O、P分别位于周期表第2、4列,P的单质被称为“未来金属”,具有质量轻、强度大、耐腐蚀性好的优点。
(1)Y、Z、M三种元素的电负性由大到小的顺序:________(用元素符号表示)。
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:__________。
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:_________。(各物质用化学式表示)
②XN的晶体的晶胞如图所示:
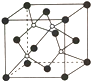
其中实心球为N,在一个晶胞中N原子空间堆积方式为______,N原子的配位数为______;该结构中有一个配位键,提供空轨道的原子是________(写元素符号)。
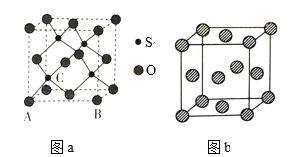
(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______。
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为_____g·cm-3(用含a和NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在25℃、101kPa时,H2与O2化合生成1molH2O(g)放出241.8kJ的热量,其热化学方程式为______.
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g)△H=______kJ/mol.
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
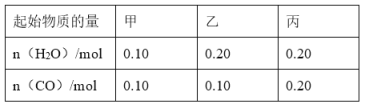
①该反应的平衡常数表达式为______.
②平衡时,甲容器中CO的转化率是______;容器中CO的转化率:乙______甲;丙______甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度______(填“升高”或“降低”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com