
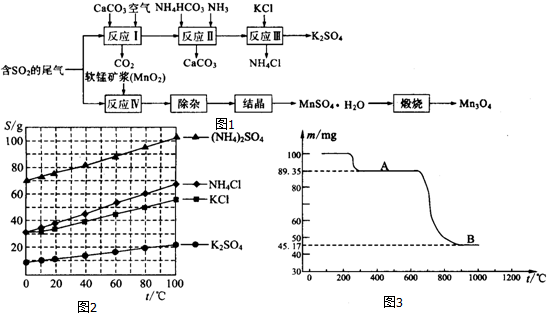
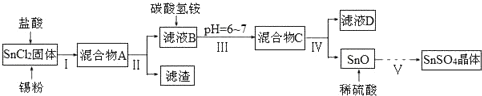
分析 (1)硫酸钾的溶解度受温度的影响较小,趁热过滤减少杂质;
(2)检验Cl-用硝酸银溶液和稀硝酸,同时又要除去干扰实验的硫酸根离子;
(3)二氧化硫与二氧化锰反应,除杂后得到硫酸锰晶体,可知二者反应生成硫酸锰;
(4)+4价锰离子具有氧化性可以氧化氯离子为氯气,四氧化三锰可改写为MnO2•2MnO,MnO2与浓盐酸生成MnCl2、Cl2和H2O、MnO与盐酸生成MnCl2和H2O;
(5)热重曲线中一般先失去结晶水(可能分步),100gMnSO4•H2O中结晶水的质量为100g×$\frac{18}{55+96+18}$=10.65g,可知A为硫酸锰,升高温度盐分解得到金属氧化物,由流程图可知硫酸锰晶体锻烧得到四氧化三锰,100gMnSO4•H2O分解可以得到四氧化三锰的质量为$\frac{100g}{(55+96+18)g/mol}$×$\frac{1}{3}$×229g/mol=45.17g,故B为Mn3O4;继续加热产物中总锰含量反而减小,说明吸收了氧,进一步说明B中的锰元素存在低价.
解答 解:(1)四种物质中相同温度下硫酸钾溶解度最小,所以反应Ⅲ中蒸发浓缩后硫酸钾析出,趁热过滤减少杂质,得硫酸钾晶体,再洗涤、干燥即可,
故答案为:趁热过滤;
(2)检验Cl-用硝酸银溶液和稀硝酸,同时又要除去干扰实验的硫酸根离子,具体方案为:取少量溶液于试管中配成溶液,滴加过量的Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,
故答案为:取少量溶液于试管中配成溶液,滴加过量的Ba(NO3)2溶液,取上层清液滴加AgNO3溶液;
(3)二氧化硫与二氧化锰反应,除杂后得到硫酸锰晶体,可知二者反应生成硫酸锰,反应方程式为:MnO2+SO2=MnSO4,
故答案为:MnO2+SO2=MnSO4;
(4)+4价锰离子具有氧化性可以氧化氯离子为氯气,四氧化三锰可改写为MnO2•2MnO,MnO2与浓盐酸生成MnCl2、Cl2和H2O、MnO与盐酸生成MnCl2和H2O,反应方程式为:Mn3O4+8H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$3Mn2++Cl2↑+4H2O,
故答案为:Mn3O4+8H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$3Mn2++Cl2↑+4H2O;
(5)①热重曲线中一般先失去结晶水(可能分步),100gMnSO4•H2O中结晶水的质量为100g×$\frac{18}{55+96+18}$=10.65g,可知A为硫酸锰,升高温度盐分解得到金属氧化物,由流程图可知硫酸锰晶体锻烧得到四氧化三锰,100gMnSO4•H2O分解可以得到四氧化三锰的质量为$\frac{100g}{(55+96+18)g/mol}$×$\frac{1}{3}$×229g/mol=45.17g,故B为Mn3O4,
故答案为:Mn3O4;
②继续加热产物中总锰含量反而减小,说明吸收了氧,进一步说明B中的锰元素存在低价,可能是部分Mn3O4又被氧化成Mn2O3或MnO2,造成总锰含量减少,
故答案为:部分Mn3O4又被氧化成Mn2O3或MnO2,造成总锰含量减少.
点评 本题考查物质制备工艺流程、离子检验、陌生方程式书写、物质的分离提纯、化学反应图象等,(5)中注意利用验证法解答,避免计算确定B的化学式中繁琐数据处理.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出akJ/mol | ||
| 乙 | 1mol | 1mol | 放出bkJ/mol | ||
| 丙 | 2mol | 2mol | 放出ckJ/mol | ||
| 丁 | 3mol | 2mol | 吸收dkJ/mol |
| A. | c+d<Q | |
| B. | 平衡时,甲、丁容器中X、W的转化率之和大于1 | |
| C. | 平衡时丙容器中Z的物质的量浓度最大 | |
| D. | X的转化率为:甲<乙<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: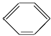 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ 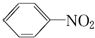 +H2O△H<0
+H2O△H<0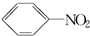 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ 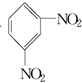 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
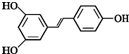 .根据要求回答下列问题:
.根据要求回答下列问题: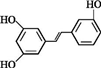 .
.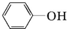 )都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.
)都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com