
能正确表示下列反应的离子方程式是 ( )
A.向氢氧化钠溶液中通入Cl2:Cl2+ 2OH-= Cl- +ClO- +H2O
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
C.氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-=BaSO4↓
D.高锰酸钾溶液与浓盐酸混合:2MnO4- +2Cl- +16H+=2Mn2++Cl2↑+8H2O
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.该反应属于复分解反应
B.该反应利用了Cl2的强氧化性
C.若管道漏气遇氨就会产生白烟
D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,下列结论中错误的是
A.Fe3+的氧化性比溴的氧化性强
B.该晶体中一定含有SCN-
C.Fe2+与SCN-不能形成红色化合物
D.Fe2+被溴氧化成Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:实验题
(13分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化的含量,请填写下列空白:
移取10.00 ml密度为ρ g/mL的过氧化氢溶液至烧杯后全部将其转移到250 ml (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
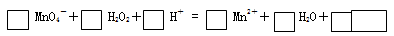
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4)复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾演粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)请将他们的实验方法和实验现象填入下表:
实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
验证氧化性 |
|
|
验证不稳定性 |
|
|
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
对于反应KClO3+ HCl = KC1 + Cl2 ↑+ H2O(未配平)若有0.1 mol KClO3 参加反应,下列说法正确的是 ( )
A.转移0.5 mol电子 B.生成0.1 mol Cl2
C.被氧化的HC1为0.6 mol D.Cl2是只是氧化产物不是还原产物
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
⑴Cl2+2KI=2KCl+I2; ⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,⑷H2S+I2=S+2HI;
A.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
A.Cl2 B.SO2 C.NaClO D.KMn04
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,

下列说法正确的是
A.d点溶液中含有的溶质有Na2SO4 、NaAlO2、NH3?H2O
B.原溶液中含有的Fe3+、Mg2+和Al3+的物质的量之比为1:1:1
C.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH—= Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓
D.原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:填空题
Ⅰ.氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2 Si3N4+6CO;?H <0。
Si3N4+6CO;?H <0。
(1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如图所示,

②和③分别仅改变一种反应条件。所改变的条件分别是:② ;③ 。
(2)1 000℃时,在2 L密闭容器中进行上述反应,若起始时N2浓度为4.0 mol/L,经1小时反应达到平衡状态,此时容器内气体总浓度为10.0 mol/L,则以CO表示的反应速率为 。
Ⅱ.图为Mg—NaClO燃料电池结构示意图。

已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极。
(1)Y电极材料为 。
(2)X电极发生的电极反应式为 。
(3)若该电池开始时加入1L 0.2mol/L的NaOH溶液,然后从下口充入1L 0.1mol/L的NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的pH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com