
【题目】I某温度下,Kw=10﹣12 .
(1)若保持温度不变,向少量水中加入g的NaOH固体,并加水至1L,才能使溶液中电离产生的H+、OH﹣的浓度乘积即:c(H+)c(OH﹣)=10﹣22
(2)若保持温度不变,某溶液中c(H+)为1×10﹣7mol/L,则该溶液显性(选填“酸”、“碱”或“中”)
(3)已知常温下Kw[Fe(OH)3]=4.0×10﹣38 , 在FeCl3溶液中加入NaHCO3溶液,发生反应的离子方程式为 . 若所得悬浊液的pH调整为4,则溶液中Fe3+的浓度为mol/L.
(4)试利用平衡移动原理解释下列事实:
FeS不溶于水,但能溶于稀盐酸中 .
【答案】
(1)4
(2)碱
II.(3)实验室中常用NaOH进行洗气和提纯,当600mL 1mol/LNaOH溶液吸收标准状况下8.96LCO2气体时所得溶液中各离子浓度由大到小的顺序是 ?????? .
c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
(3)Fe3++3HCO3﹣=Fe(OH)3↓+3CO2↑;4.0×10﹣8
(4)FeS(s)?Fe2+(aq)+S2﹣(aq),加入稀盐酸后,S2﹣+2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向FeS溶解的方向移动,故FeS溶解
【解析】解:I.(1)水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣22 , 则c(H+)=10﹣11mol/L,已知Kw=10﹣12 , c(OH)= ![]() =0.1mol/L,则氢氧化钠的物质的量为0.1mol/L×1L=0.1mol,则质量为0.1mol×40g/mol=4g,所以答案是:4;(2)若保持温度不变,已知Kw=10﹣12 , 中性溶液中pH=6,某溶液中c(H+)为1×10﹣7mol/L<1×10﹣6mol/L,溶液显碱性,所以答案是:碱;
=0.1mol/L,则氢氧化钠的物质的量为0.1mol/L×1L=0.1mol,则质量为0.1mol×40g/mol=4g,所以答案是:4;(2)若保持温度不变,已知Kw=10﹣12 , 中性溶液中pH=6,某溶液中c(H+)为1×10﹣7mol/L<1×10﹣6mol/L,溶液显碱性,所以答案是:碱;
II.(3)n(NaOH)=1mol/L×0.6L=0.6mol,n(CO2)= ![]() =0.4mol,n(NaOH):n(CO2)=0.6mol:0.4mol=3:2,
=0.4mol,n(NaOH):n(CO2)=0.6mol:0.4mol=3:2,
设生成的n(Na2CO3)=xmol、n(NaHCO3)=ymol,
根据Na、C原子守恒得 ![]() ,解得
,解得 ![]() ,
,
所以溶液中溶质为等物质的量浓度的Na2CO3、NaHCO3 , 碳酸根离子水解程度大于碳酸氢根离子,但其水解程度都较小,二者水解导致溶液呈碱性,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),
所以答案是:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+);(4)在FeCl3溶液中加入NaHCO3溶液,二者发生双水解反应生成氢氧化铁沉淀和二氧化碳,离子方程式为Fe3++3HCO3﹣=Fe(OH)3↓+3CO2↑;溶液的pH=4,则溶液中c(OH﹣)= ![]() mol/L=10﹣10 mol/L,c(Fe3+)=
mol/L=10﹣10 mol/L,c(Fe3+)= ![]() =
= ![]() mol/L=4.0×10﹣8mol/L;
mol/L=4.0×10﹣8mol/L;
所以答案是:Fe3++3HCO3﹣=Fe(OH)3↓+3CO2↑;4.0×10﹣8;(5)FeS(s)Fe2+(aq)+S2﹣(aq),加入稀盐酸后,S2﹣+2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向FeS溶解的方向移动,则FeS能溶于稀盐酸,
所以答案是:FeS(s)Fe2+(aq)+S2﹣(aq),加入稀盐酸后,S2﹣+2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向FeS溶解的方向移动,故FeS溶解.


科目:高中化学 来源: 题型:
【题目】向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度;
(2)在标准状况下产生气体的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫代硫酸钠(Na2S2O3·5H2O)俗称海波。医药上用作洗涤剂、消毒剂。根据化合价原理可知Na2S2O3·5H2O中S元素的化合价为
A. +6B. +4C. +2D. -2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
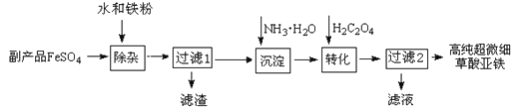
已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3
②5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2↑+2Mn2+ +8H2O
(1)除杂过程中加入Fe的作用是___________________________。
(2)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2mol·L-1 的H2SO4溶解。
步骤2:用c mol·L-1标准KMnO4溶液滴定,消耗其体积a mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液b mL。
① KMnO4溶液应该装在_______________滴定管中。
② 用KMnO4溶液滴定待测液,达到滴定终点的标志是__________________________________。
③ 下列操作会导致测定结果中样品的C2O42- 的物质的量偏大的是____________________
A. 步骤2中,滴定管未用标准KMnO4 溶液润洗
B. 步骤3中加入Zn不足
C. 步骤2中,读标准溶液体积时,先仰视后俯视
D. 步骤4中,读标准溶液体积时,先俯视后仰视
④ 样品中C2O42- 的物质的量为_______________________。
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+ 的浓度随反应时间t的变化如下图,其变化趋势的原因可能为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①相同温度下,同浓度的5中溶液中,水的电离程度的大小顺序为:E=B>C>A=D
②B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
③浓度均为0.1mol·L-1 C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是___________,E是___________;
(2)用水稀释0.1mol·L-1 B溶液时,溶液中随着水量的增加而减小的是_________(填写序号)
a. ![]() b.
b. ![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是_____________(填写序号)。
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中________曲线(填写序号)。
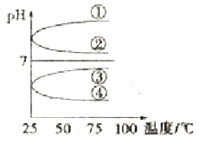
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业是国民经济支柱产业之一,也是新兴科学技术发展产业.曾经电子工业常用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为:2FeCl3+Cu═2FeCl2+CuCl2 .
(1)检验腐蚀后的溶液中是否含有Fe3+ , 应选用的试剂是 .
(2)为了从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液,采用如图所示实验步骤.请在各空格内填上适当的化学式以使实验达到预期目的.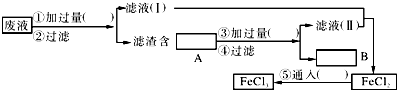
(3)写出有关化学反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5:1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=4.0×10﹣3mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com