
[ ]
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:浙江省温州中学2011-2012学年高二下学期期末考试化学试题 题型:058
(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略).

①写出制备阿司匹林的化学方程式________.可用重结晶提纯法提纯阿司匹林.方法如下:加热回流的装置如图所示:
②使用温度计的目的是________.
③冷凝水的流进方向是________.(填“b”或“c”).
④重结晶提纯法所得产品的有机杂质较少的原因________.
检验产品中是否含有水杨酸的化学方法是________.
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测.每一组检测按照如下步骤进行:
A.称取0.300 g样品.
B.将样品与25 mL 4 mol·L-1 NaOH溶液在三颈烧瓶中混合,水浴加热回流1小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+NaCl).
C.在三颈烧瓶中加入50 mL 2 mol·L-1 HNO3,混合均匀.
D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容.
E.从容量瓶中取出25.00 mL溶液于锥形瓶中,加入6.00 mL 0.100 mol·L-1 AgNO3溶液,振荡混合均匀.
F.在锥形瓶中滴入几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250 mol·L-1 NH4SCN溶液滴定剩余的AgNO3.
G.重复E、F步骤三次,消耗0.0250 mol·L1 NH4SCN溶液的平均值为4.00 mL.
(已知:NH4SCN+AgNO3=AgSCN↓+NH4NO3)根据以上实验信息回答下列相关问题:
①C步骤所加硝酸的目的是________.
②在F步骤操作中,判断达到滴定终点的现象是________.
③该产品的纯度为________.(请保留2位小数)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州中学高二下学期期末考试化学试卷(带解析) 题型:实验题
(12分)(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略)。
①写出制备阿司匹林的化学方程式 。
可用重结晶提纯法提纯阿司匹林。方法如下:
加热回流的装置如图所示:
②使用温度计的目的是 。
③冷凝水的流进方向是 。(填“b”或“c”)。
④重结晶提纯法所得产品的有机杂质较少的原因 。
检验产品中是否含有水杨酸的化学方法是 。
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测。每一组检测按照如下步骤进行:
| A.称取0.300 g样品。 |
| B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。 |
| C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。 |
| D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期末考试化学试卷(解析版) 题型:实验题
(12分)(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略)。
①写出制备阿司匹林的化学方程式 。
可用重结晶提纯法提纯阿司匹林。方法如下:
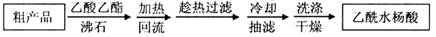
加热回流的装置如图所示:
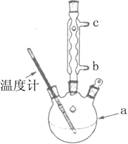
②使用温度计的目的是 。
③冷凝水的流进方向是 。(填“b”或“c”)。
④重结晶提纯法所得产品的有机杂质较少的原因 。
检验产品中是否含有水杨酸的化学方法是 。
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测。每一组检测按照如下步骤进行:
A.称取0.300 g样品。
B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。
C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。
D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。
E.从容量瓶中取出25.00 mL溶液于锥形瓶中,加入6.00 mL 0.100 mol·L-1AgNO3溶液,振荡混合均匀。
F.在锥形瓶中滴入几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250 mol·L-1 NH4SCN溶液滴定剩余的AgNO3。
G.重复E、F步骤三次,消耗0.0250 mol·L1NH4SCN溶液的平均值为4.00mL。
(已知:NH4SCN+ AgNO3= AgSCN↓+NH4NO3)根据以上实验信息回答下列相关问题:
①C步骤所加硝酸的目的是 。
②在F步骤操作中,判断达到滴定终点的现象是 。
③该产品的纯度为 。(请保留2位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com