
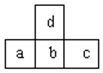
| A. | d的氢化物比b的氢化物稳定 | |
| B. | d与c不能形成化合物 | |
| C. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| D. | 原子半径的大小顺序是a>b>c>d |
分析 由元素在短周期中的位置可知d位于第二周期,a、b、c位于第三周期,a原子最外层电子数比次外层电子数少3个,故a原子最外层电子数为5,故a为P元素,可知b为S元素,c为Cl元素,d为O元素,结合元素周期律解答.
解答 解:由元素在短周期中的位置可知d位于第二周期,a、b、c位于第三周期,a原子最外层电子数比次外层电子数少3个,故a原子最外层电子数为5,故a为P元素,可知b为S元素,c为Cl元素,d为O元素.
A.非金属性O>S,非金属性越强氢化物越稳定,故d的氢化物比b的氢化物稳定,故A正确;
B.氧元素与氯元素可以形成多种氯的氧化物,故B错误;
C.同周期自左而右非金属性增强,故非金属性a<b<c,非金属性越强最高价氧化物对应水化物的酸性越强,故最高价氧化物对应水化物的酸性c>b>a,故C正确;
D.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径P>S>Cl>O,即a>b>c>d,故D正确;
故选B.
点评 本题考查结构位置性质关系应用,题目难度中等,推断元素为解答关键,注意整体把握元素周期表的结构,熟练掌握元素周期律.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | 溶液pH值增大 | ||
| C. | 溶液中c(Ca2+)增大 | D. | 溶液pH值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
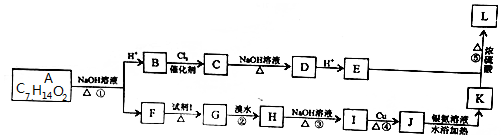
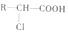
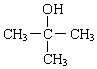 、
、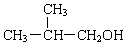 .
.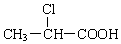 +2 NaOH$→_{△}^{水}$
+2 NaOH$→_{△}^{水}$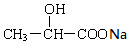 +NaOH+H2O.
+NaOH+H2O.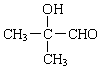 +2 Ag(NH3)2OH$\stackrel{△}{→}$
+2 Ag(NH3)2OH$\stackrel{△}{→}$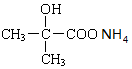 +2 Ag↓+3NH3+H2O.
+2 Ag↓+3NH3+H2O.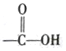
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
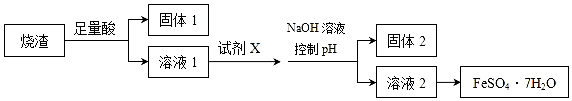
| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
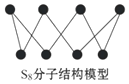
| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com