
【题目】实验室需要0.5 mol/L H2SO4溶液500 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号)。
(2)下列操作中,500ml容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取220 mL溶液
(3)实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液的浓度将____ 0.5mol/L(填“大于”“等于”或“小于”,下同)。若溶液未冷却即转移至容量瓶定容,则所配制溶液浓度将________0.5 mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。
【答案】A C BCD 小于 大于 13.6
【解析】
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质;
(3)根据m=nM=cVM计算氢氧化钠的质量;根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)浓硫酸的物质的量浓度c= ![]() ,再根据稀释公式可以求得需要浓硫酸的体积。
,再根据稀释公式可以求得需要浓硫酸的体积。
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以不需要的仪器是AC,故答案为:A C;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质;故选BCD;
(3)若定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度 小于0.5mol/L;溶液有热胀冷缩的性质,若NaOH在溶解后未冷却到室温便注入容量瓶内,导致溶液的体积偏小,所以配制溶液的浓度偏高,即故所得溶液浓度大于0.5mol/L,故答案为:小于;大于;
(4)质量分数为98%,密度为1.84g/cm3的浓硫酸的物质的量浓度c= ![]() =
= ![]() =18.4mol/L,需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:0.5L×0.5mol/L=V×18.4mol/L解得V=0.0136L=13.6mL,正确答案是13.6mL。
=18.4mol/L,需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:0.5L×0.5mol/L=V×18.4mol/L解得V=0.0136L=13.6mL,正确答案是13.6mL。


科目:高中化学 来源: 题型:
【题目】从八角茴香中提取的莽草酸,是合成治疗禽流感的药物——达菲( Tamiflu) 的原料之一。其结构简式如图,下列有关莽草酸分子的说法正确的是
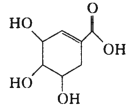
A.含有两种不同的官能团
B.7个碳原子共面
C.1mol能与4molNaOH 完全反应
D.既能使 Br2的CCl4溶液褪色 ,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用离子方程式2H+ + CO32-=CO2↑ + H2O表示的是
A.HCl溶液与MgCO3反应
B.CH3COOH与K2CO3溶液反应
C.HNO3溶液与NaHCO3溶液反应
D.H2SO4溶液与(NH4)2CO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雌二醇的结构简式如图,下列说法不正确的是
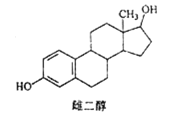
A. 能与 Na、NaOH溶液、Na2CO3溶液反应
B. 能发生加成反应、取代反应、消去反应
C. 该分子中所有碳原子不可能在同一个平面内
D. 可与 FeC13溶液发生显色反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增加,且均不大于20。
的原子序数依次增加,且均不大于20。![]() 、
、![]() 、
、![]() 族序数之和为10;
族序数之和为10;![]() 的原子半径在同周期主族元素中最小;
的原子半径在同周期主族元素中最小;![]() 与
与![]() 形成的化合物常温下可与饱和
形成的化合物常温下可与饱和![]() 溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.简单离子半径:![]()
B.![]() 的单质是人类将太阳能转化为电能的常用材料
的单质是人类将太阳能转化为电能的常用材料
C.![]() 与
与![]() 形成的化合物均满足8电子稳定结构
形成的化合物均满足8电子稳定结构
D.![]() 与
与![]() 形成的化合物与饱和
形成的化合物与饱和![]() 溶液的反应可选用启普发生器
溶液的反应可选用启普发生器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com