
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
【答案】 离子键 共价键 分子间 SiO2>KClO3>I2 ①⑤③②④⑥ CO2 H2 H2、CO2、HF HF (NH4)2SO4 SiC SiC>(NH4)2SO4>HF>CO2>H2 金属晶体 分子晶体 离子晶体 原子晶体 氯化铯 氯化钠 二氧化硅 金刚石
【解析】
(1)氯酸钾是离子晶体,熔化时破坏离子键;二氧化硅是原子晶体熔化时破坏共价键;碘是分子晶体,升华时粒子间克服分子间作用力;熔点:原子晶体![]() 离子晶体
离子晶体![]() 分子晶体,所以熔点大小顺序为: SiO2>KClO3>I2;
分子晶体,所以熔点大小顺序为: SiO2>KClO3>I2;
(2)根基晶体类型分析,原子晶体![]() 离子晶体
离子晶体![]() 分子晶体,Si和金刚石都是原子晶体,原子半径越小,共价键越强,熔点越高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,所以熔点低到高的顺序为:①⑤③②④⑥;
分子晶体,Si和金刚石都是原子晶体,原子半径越小,共价键越强,熔点越高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,所以熔点低到高的顺序为:①⑤③②④⑥;
(3)由极性键形成的非极性分子有CO2,由非极性键形成的非极性分子有H2,能形成分子晶体的物质是H2、CO2、HF,含有氢键的晶体的化学式是 HF,属于离子晶体的是(NH4)2SO4,属于原子晶体的是SiC,五种物质的熔点由高到低的顺序是SiC>(NH4)2SO4>HF>CO2>H2; (4)根据晶体的物理性质分析,A.固态时能导电,能溶于盐酸,属于金属晶体;B.能溶于CS2,不溶于水,根据相似相溶原理,CS2为分子晶体,故B属于分子晶体;C.固态时不导电,液态时能导电,可溶于水,属于离子晶体,D.固态、液态时均不导电,熔点为3 500℃,属于原子晶体;
(5)由晶胞结构模型可以知道A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图所示是元素周期表的轮廓图,根据元素①~⑩在周期表中的位置,按题目要求回答问题:
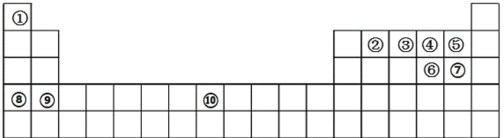
(1)元素①、②能形成 16 电子的分子,该分子的电子式为________________, 元素①、③能形成 10 电子的分子,请用电子式表示该物质的形成过程_______________________;
(2)元素④、⑤、⑥形成的简单氢化物的热稳定性从小到大顺序为___________________(用化学式表示);
(3)将过量的元素⑩单质加入到元素③最高价氧化物水化物的稀溶液中,发生反应的离子反应方程式为_______;
(4)铅元素在元素周期表中的位置为________________,铅酸蓄电池是典型的二次电池,在生活中有广泛的应用,其放电时正极的电极反应式为________________,放电一段时间后,正极质量增加 6.4g,则这段时间,转移电子物质的量为__________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用含铅废料(主要含PbO、PbSO4和PbO2)制备化工产品(PbSO4·3PbO·H2O)的工艺流程如图:

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题:
(1)“转化”时,加入Na2CO3的目的是将PbSO4转化成PbCO3,其转化原理是___________。PbO2转化为PbCO3的离子方程式为_________。
(2)该流程中可以循环利用的物质是_________,若其中残留过多SO42-,循环利用可能出现的问题是__________。
(3)一定浓度的硝酸溶解PbCO3和PbO时,“酸溶”时,金属离子浸出率与温度的关系如图所示。当温度为40℃,金属离子浸出率最高,其主要原因是________。

(4)取一定量的含铅废料经上述“转化”,假设含铅废料中的PbO2和PbSO4全部转化成PbCO3,且PbO未发生反应,“酸溶”时共收集到5.6 L CO2(标准状况),“沉铅”时得到121.2 g PbSO4。
①原含铅废料中含PbO的物质的量为__________。
②“合成”时,加入NaOH的质量为__________。
(5)工业上,电解Pb(NO3)2溶液制备活性电极材料PbO2,其阳极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用SiC与Cl2反应(SiC+2Cl2![]() SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是
SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是
A. 制取氯气
制取氯气
B. 净化氯气,气体从接口①进入
净化氯气,气体从接口①进入
C. 制取四氯化硅
制取四氯化硅
D. 收集四氯化硅粗产品
收集四氯化硅粗产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
A. CO2、H2、CH3OH、H2O的浓度一定相等
B. 该反应已经达到化学平衡状态
C. CO2和H2完全转化为CH3OH和H2O
D. CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
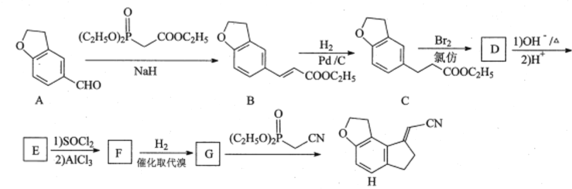
【题目】化合物H是制备某褪黑素受体激动剂的中间体,其合成路线如下:
已知:RCOOH![]()
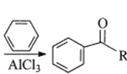 ,其中—R为烃基。
,其中—R为烃基。
(1)A中含氧官能团的名称为__________和__________。
(2)B→C的反应类型为___________。
(3)F的分子式为C11H8O2Br2,写出F的结构简式:________
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_____。
①能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和![]() 为原料制备
为原料制备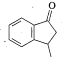 的合成路线流程图______________(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图______________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 核磁共振氢谱、红外光谱都能够快速精确地测定有机物的相对分子质量
B. 异戊烷和新戊烷可以用质谱法快速的区分
C. 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体
D. ![]() 互为同系物
互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com