
 常温下,将0.1000mol.L-1NaOH溶液滴入20.00mL0.1000mol.L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示.
常温下,将0.1000mol.L-1NaOH溶液滴入20.00mL0.1000mol.L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示.分析 (1)由图象可知0.1000mol L-1的一元酸HA溶液pH约为4,可证明HA为弱酸,据此写出反应的离子方程式;
(2)图中②点酸过量,溶液呈酸性,结合物料守恒和电荷守恒解答该题;
(3)由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL.
解答 解:(1)由图象可知0.1000mol L-1的一元酸HA溶液pH约为4,说明HA为弱酸,则发生反应的离子方程式为:HA+OH-=A-+H2O,
故答案为:HA+OH-=A-+H2O;
(2)A.②点时加入NaOH物质的量为HA的物质的量的$\frac{1}{2}$,由物料守恒可知:2c(Na+)=c(HA)+c(A-),故A正确;
B.根据电荷守恒可知:c(Na+)+c(H+)=c(A-)+c(OH-),故B正确;
C.②点时加入热NaOH物质的量为HA的物质的量的$\frac{1}{2}$,反应后溶质为等浓度的NaA和HA,混合液呈酸性,则A-的水解程度小于HA的电离程度,则c(A-)>c(Na+),故C错误;
D.①点时溶质为HA,不存在钠离子,所以①点溶液中离子与②③点所含微粒种类不同,故D错误;
故答案为:AB;
(3)由于HA为弱酸,③点时溶液呈中性,加入NaOH体积应小于20.00mL,
故答案为:<.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,根据图象判断HA为弱酸为解答该题的关键,注意掌握酸碱混合的定性判断及pH的计算方法,明确离子浓度大小的判断方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子数之比是1:1 | B. | 原子个数比是3:2 | C. | 质子数比是 3:2 | D. | 密度之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
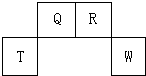 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ;W在周期表中的位置是第三周期VIA族;
;W在周期表中的位置是第三周期VIA族;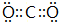 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③④ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇(水):加入新制生石灰,然后蒸馏 | |
| B. | 乙酸乙酯(乙醇):加入饱和碳酸钠溶液,然后分液 | |
| C. | 甲烷(乙烯):通入溴水溶液 | |
| D. | 乙烷(乙烯):通入酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在水层中反应并四处游动 | |
| B. | 钠在苯与CuSO4溶液的界面处反应并作上下跳动 | |
| C. | 烧杯中有气泡产生 | |
| D. | 烧杯底部有蓝色沉淀物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com