
为研究盛装浓硫酸的铁质材料(碳素钢)与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)实验:称取铁钉5.6 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用
(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取448 mL(标准状况)气体Y通入足量溴水中,发生的反应式为:Br2+SO2+2H2O====2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为 。
(2)提出猜想:分析上述实验中SO2体积分数的结果,同学们认为气体Y中还可能含有其他气体并作如下猜想:
猜想一:Y气体中可能含有H2;
猜想二: ;
猜想三: 。
(3)设计实验,验证猜想:为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省略)。
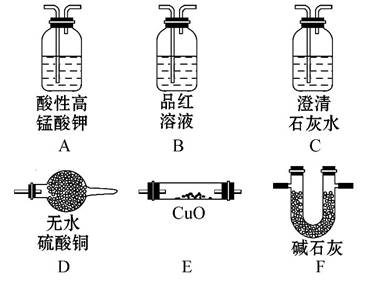
①实验装置的连接顺序为A→ → →F→ → __________→F(填字母)。
②装置B中试剂的作用是 。
③猜想一的理由是
(用化学方程式表示)。
④如果猜想一成立,预计实验现象应该是
。
【解析】(1)①a项,X中含有Fe3+,加KSCN溶液变红,无法证明含Fe2+;b项,X中若含Fe3+不含Fe2+,加铁粉和KSCN溶液仍无色,无法证明含Fe2+;c项,浓氨水与Fe3+反应干扰浓氨水与Fe2+反应生成的白色沉淀;d项,Fe2+有还原性,Fe3+无还原性,Fe2+能使酸性KMnO4溶液褪色。
②由关系式SO2~H2SO4~BaSO4可知
n(SO2)=n(BaSO4)=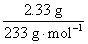 =0.01 mol
=0.01 mol
故SO2的体积分数为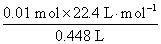 ×100%=50%。
×100%=50%。
(2)铁质材料含Fe和C,加热时,Fe、C与浓硫酸反应时生成SO2和CO2,当变为稀硫酸时,Fe与稀硫酸反应又生成H2。
(3)SO2、CO2共存时检验方法思路:
先验SO2→吸收SO2→验SO2除尽→验CO2
H2检验的方法思路:干燥H2→热CuO→验H2O
答案:(1)①d ②50%
(2)Y气体中可能含有CO2
Y气体中可能含有H2和CO2
(3)①B C E D ②检验SO2是否除尽
③Fe+H2SO4====FeSO4+H2↑
④E中固体由黑变红,D中固体由白变蓝色,C中无明显现象


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
下列示意图与对应的反应情况正确的是
A B C D
A.含0.01molKOH 和0.01mol Ca(OH)2 的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液
C. n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是( )
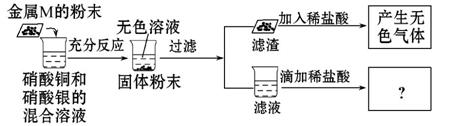
A.向滤液中滴加盐酸的实验现象是产生白色沉淀
B.滤渣可能是两种金属单质的混合物
C.滤渣在足量的稀硝酸中能完全溶解
D.加入的金属M可能是镁或钠
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明一氧化碳具有还原性,有人设计了下列实验:
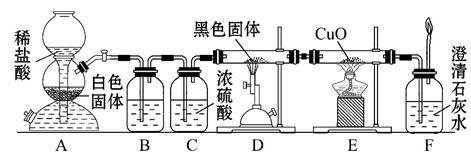
(1)装置B中最适宜的试剂是_________ 。
(2)装置D中发生反应的化学方程式是 _______。
(3)必须用装置C吸收除去气体中水蒸气的理由是____________。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与 之间连接下列装置中的 (填序号)。
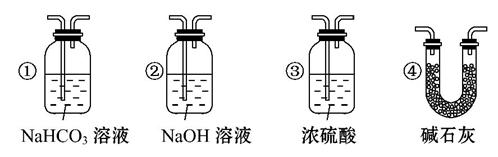
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2是常见的大气污染物之一,下列措施中能够减少SO2排放量的是( )
①用天然气代替煤炭作民用燃料
②使用水煤气或干馏煤气作燃料
③硫酸厂使用V2O5作催化剂,加快SO2的转化速率
④将块状煤粉碎,提高其燃烧效率
⑤在煤中加入生石灰后燃烧
⑥循环处理吸收塔放出的尾气
A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年国庆长假京城大堵车的场面“蔚为壮观”,大量汽车尾气(含CO、SO2和NO等)的排放带来了严重的城市空气污染,治理的方法之一是在汽车的排放管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
(1)汽车尾气中导致酸雨形成的主要物质是 。
(2)写出在催化剂的作用下CO跟NO反应的化学方程式: 。
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是
__________________________________________________________________。
(4)下列各项措施中,有利于缓解城市空气污染的有 (填序号)。
A.充分利用太阳能,减少能源消耗
B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境
D.取缔燃煤炉和木炭烧烤,改用天然气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组顺序的排列不正确的是( )
A.熔点:金刚石>食盐>干冰 B.热稳定性:HCl>H2S>PH3
C.沸点:HF>HBr>HCl D.离子半径:Na+<Mg2+<Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
【观察与思考】
(1)乙醇分子的核磁共振氢谱有 个吸收峰.
【活动与探究】
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象就填多少,不必填满).
| 实验现象 | 结论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
| ② | ||
(3)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为(生成乙醛) .欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在水浴中加热,观察现象即可,此反应的化学方程式为 .
【交流与讨论】
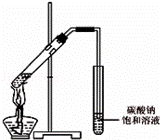
(4)丙同学向一支试管中加入3mL乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按图所示连接好装置,开始实验.请回答下列问题:
①请指出该装置的主要错误是 .
②浓硫酸的作用是 、 .
③假如乙醇分子中的氧原子为18O,请写出此反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com