
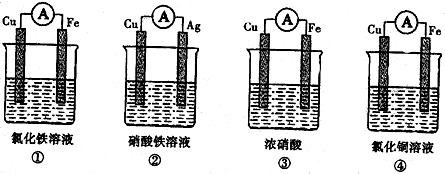
分析 (1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐;
(2)在燃料电池中,负极上是燃料发生失电子的氧化反应,正极上发生得电子的还原反应,结合电解质环境来书写电极反应式.
解答 解:(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐,
①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,故正确;
③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;
④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
故答案为:②;Cu+2Fe3+=Cu2++2Fe2+;
(2)正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-;负极上是氢气失电子的氧化反应,电极反应式为H2+2OH--2e-═2H2O,
故答案为:氧化;H2+2OH--2e-═2H2O.
点评 本题考查了原电池和电解池原理以及电极反应式的书写知识,注意学会根据元素化合价变化确定氧化性强弱,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 | |
| B. | 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 | |
| C. | 可以利用银镜反应证明反应①的最终产物为葡萄糖 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: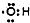 | |
| B. | 苯的分子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往硫化氢水溶液中加碱有利于S2-的增加 | |
| B. | 加入催化剂有利于氨氧化的反应 | |
| C. | 高压不利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 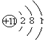 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、CH3COO-、NO3- | |
| D. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Ba2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com