
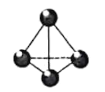
【题目】白磷(P4)的正四面体结构如图所示,能与Ba(OH)2溶液发生反应: 2P4+3Ba(OH)2 + 6H2O=3Ba(H2PO2)2 +2PH3↑。若该反应消耗白磷3.1g,则下列说法正确的是( )
A.水是还原剂,消耗水的质量为1.35g
B.产生PH3,气体560mL
C.转移0. 75 mol电子
D.反应断开了0.15 molP-P键
【答案】D
【解析】
A.根据方程式可知,水的组成元素在反应前后元素化合价没有发生变化,因此水既不是氧化剂,也不是还原剂,A错误;
B.题目未指明气体所处的外界条件,因此不能确定气体的体积大小,B错误;
C.根据方程式可知:该反应中白磷参加反应时,有![]() 的白磷失去电子,被氧化,作还原剂、
的白磷失去电子,被氧化,作还原剂、![]() 的白磷获得电子,被还原,作氧化剂,1mol白磷反应即有(31×4)g白磷反应时,转移电子的物质的量是3e-mol,则3.1g白磷反应,转移电子的物质的量是n(e-)=
的白磷获得电子,被还原,作氧化剂,1mol白磷反应即有(31×4)g白磷反应时,转移电子的物质的量是3e-mol,则3.1g白磷反应,转移电子的物质的量是n(e-)=![]() mol=0.075mol,C错误;
mol=0.075mol,C错误;
D.根据方程式可知:每有1mol(31×4)g白磷发生反应,断裂P-P键6mol,则有3.1g白磷反应,断裂P-P键的物质的量n=![]() mol=0.15mol,D正确;
mol=0.15mol,D正确;
故合理选项是D。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
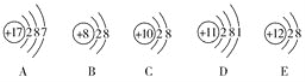
①与离子相对应的元素符号是______________,与原子相对应的离子的结构示意图是______________。
②电子层结构相同的是__________(填写代号,下同),性质最稳定的是__________,最容易失去电子的是__________,最容易得到电子的是__________。
③可直接相互结合形成的化合物的化学式是____________。可经过得失电子后再相互结合形成的化合物的化学式是______________。
④在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______________。
(2)已知元素X和Y的核电荷数均小于18,最外层电子数分别为n和(m-5),次外层有(n+2)个和m个电子,据此推断元素X和Y,其名称为X__________,Y__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2 是为了提取溴
C.实际生产中常选用Ca(OH)2 作为沉淀剂
D.工业生产中电解熔融氧化镁的方法制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种理想的绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。

查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_________________。
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是___________。
(3)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式____________________________________________;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是________________________________________。
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)______________、___________,过滤时不用普通漏斗而采用砂芯漏斗的原因是_____________________。
②晶体用乙醇洗涤的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数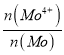 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、干燥及收集装置如图所示(省略夹持装置和尾气处理装置),仅用此装置和表中提供的物质完成相关实验,合理的是( )
选项 | a中物质 | b中物质 | c中干燥剂 | d收集气体 |
|
A | 浓硫酸 | 亚硫酸钠 | 无水氯化钙 | SO2 | |
B | 稀硫酸 | 大理石 | 无水氯化钙 | CO2 | |
C | 稀硝酸 | 铜片 | 碱石灰 | NO | |
D | 浓氨水 | 熟石灰 | 碱石灰 | NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Al(OH)3固体的熔点为300℃,电离方程式为H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() 3OH-+Al3+;②无水AlCl3晶体易升华,溶于水的电离方程式为AlCl3=Al3++3Cl-;③熔融状态的HgCl2不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH)3、AlCl3和HgCl2的说法正确的是( )
3OH-+Al3+;②无水AlCl3晶体易升华,溶于水的电离方程式为AlCl3=Al3++3Cl-;③熔融状态的HgCl2不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH)3、AlCl3和HgCl2的说法正确的是( )
A.均为强电解质B.均为弱电解质
C.均为离子化合物D.均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成某种滴眼液的原料为4-二甲氨基吡啶。下列叙述错误的是( )
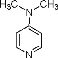
A.该分子中C原子的杂化类型有sp2、sp3
B.该分子中N原子的杂化类型有sp2、sp3
C.1mol该分子所含的σ键为15NA
D.该分子中含的大π键为Π![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通过称量![]() 样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是( )
样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是( )
A. 实验前试样未经干燥B. 试样中含有少量碳酸氢铵
C. 试样中含有少量氯化钠D. 加热过程中有试样迸溅出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com