
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末的质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体的质量/g | 0 | 1.28 | 12.8 | 24.8 |
| m |
| M |
| 11.2g |
| 56g/mol |
| 12.8g |
| 64g/mol |
| 6g |
| 56g/mol+64g/mol |
| 0.2mol |
| 0.1L |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:

| A、图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液 |
| B、图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C、图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液得到滴定曲线 |
| D、图4表示向NH4Al(SO4)2溶液中逐渐滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCO3和SiO2 |
| B、MgCO3和KHCO3 |
| C、K2CO3和Na2CO3 |
| D、Na2CO3和MgCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
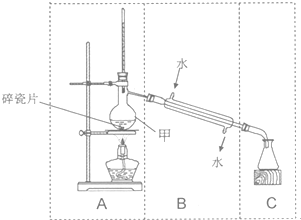
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇、1,2-二溴乙烷、乙醚的有关物理性质如表所示.
乙醇、1,2-二溴乙烷、乙醚的有关物理性质如表所示.| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常状况下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com