
 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:分析 (1)Cu的原子序数为29,价电子排布为3d104s1;C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,据此答题;
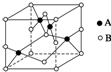
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个;
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数;
(4)CuO中的Cu显+2价,它的价电子排布式为3d9,Cu2O中的Cu显+1价,它的价电子排布式为3d10所以Cu2O中Cu的d轨道为全充满状态,较稳定;
(5)根据NaCl的摩尔质量为Mr g•mol-1及密度为ρ g•cm-3,求得晶胞的体积,进而求得棱边长,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,据此答题.
解答 解:(1)Cu的原子序数为29,价电子排布为3d104s1,则基态Cu+的核外电子排布式为[Ar]3d10,C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:[Ar]3d10,N>O>C;
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,原子个数之比为1:1,该氧化物的化学式为CuO,故答案为:CuO;
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,二者形成配位键,与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,微粒为PH3或H3O+等,故答案为:配位;sp3;PH3或H3O+等;
(4)CuO中的Cu显+2价,它的价电子排布式为3d9,Cu2O中的Cu显+1价,它的价电子排布式为3d10所以Cu2O中Cu的d轨道为全充满状态,较稳定,所以CuO高温易转化为Cu2O.故答案为:Cu2O中Cu的d轨道为全充满状态,较稳定;
(5)设晶胞边长为a,在NaCl晶胞中,含4个Cl-,含4个Na+,根据密度公式ρ=$\frac{\frac{4Mr}{N{\;}_{A}}}{{a}^{3}}$,可得a=$\root{3}{\frac{4M{\;}_{r}}{ρN{\;}_{A}}}$cm,所以晶胞面对角线长为$\sqrt{2}×$$\root{3}{\frac{4M{\;}_{r}}{ρN{\;}_{A}}}$cm,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4M{\;}_{r}}{ρN{\;}_{A}}}$cm,故答案为:$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4M{\;}_{r}}{ρN{\;}_{A}}}$.
点评 本题考查较综合,涉及电子排布、晶胞计算、杂化方式、等电子体、离子晶体熔点比较等,侧重原子结构与性质的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 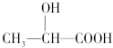 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与氧化铁的反应 | B. | 炽热的炭与二氧化碳的反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 氢氧化钠与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)>c(CH3COO-)+c(OH-) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| B. | 电子云图中的小黑点密度大,说明该原子核外空间电子数目多 | |
| C. | 光谱分析可用于鉴定元素 | |
| D. | 3d3表示3d能级有3个轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有碳碳三键的脂肪烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)=CO2(g)△H=+110.5 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com