
”¾ĢāÄæ”æĻąĶ¬ĪĀ¶ČĻĀ£¬ČŻ»ż¾łŗćĪŖ2LµÄ¼×”¢ŅŅ”¢±ū3øöĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ2SO2£Øg£©+O2£Øg£©![]() 2SO3£Øg£©£» ”÷H=-197kJ”¤mol-l”£ ŹµŃé²āµĆĘšŹ¼”¢Ę½ŗāŹ±µÄÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
2SO3£Øg£©£» ”÷H=-197kJ”¤mol-l”£ ŹµŃé²āµĆĘšŹ¼”¢Ę½ŗāŹ±µÄÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
ČŻĘ÷ | ĘšŹ¼ø÷ĪļÖŹµÄĪļÖŹµÄĮæ/mol | “ļµ½Ę½ŗāŹ±ĢåĻµÄÜĮæµÄ±ä»Æ | |||
SO2 | O2 | SO3 | Ar | ||
¼× | 2 | 1 | 0 | 0 | ·Å³öČČĮæ£ŗQ1 |
ŅŅ | 1.8 | 0.9 | 0.2 | 0 | ·Å³öČČĮæ£ŗQ2=78.8kJ |
±ū | 1.8 | 0.9 | 0.2 | 0.1 | ·Å³öČČĮæ£ŗQ3 |
ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
A.Q1>Q3>Q2 =78£®8kJ
B.ČżøöČŻĘ÷ÖŠ·“Ó¦µÄĘ½ŗā³£Źż¾łĪŖK=2
C.¼×ÖŠ·“Ó¦“ļµ½Ę½ŗāŹ±£¬ČōÉżøßĪĀ¶Č£¬ŌņSO2µÄ×Ŗ»ÆĀŹ½«“óÓŚ50%
D.ČōŅŅČŻĘ÷ÖŠµÄ·“Ó¦¾tmin“ļµ½Ę½ŗā£¬Ōņ0~tminÄŚ£¬v£ØO2£©=1/5t mol/£ØL”¤min£©
”¾“š°ø”æD
”¾½āĪö”æ
ŅŅ”¢±ū×Ŗ»Æµ½×ó±ß£¬SO2”¢O2µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol£¬Óė¼×ÖŠSO2”¢O2µÄĪļÖŹµÄĮæ¶ŌÓ¦ĻąµČ£¬ŗćĪĀŗćČŻĢõ¼žĻĀ£¬±ūÖŠAr²»Ó°ĻģĘ½ŗāŅĘ¶Æ£¬¹ŹČżÕßĪŖĶźČ«µČŠ§Ę½ŗā£¬Ę½ŗāŹ±SO2”¢O2”¢SO3µÄĪļÖŹµÄĮæ¶ŌÓ¦ĻąµČ”£
A.ÓÉÓŚĘ½ŗāŹ±¶žŃõ»ÆĮņĪļÖŹµÄĮæĻąµČ£¬¹Ź²Ī¼Ó·“Ó¦¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæ£ŗ¼×>ŅŅ=±ū£¬¹Ź·Å³öČČĮæ£ŗQ1>Q3=Q2=78.8kJ£¬¹ŹA“ķĪó£»
B.¼×”¢ŅŅ”¢±ūȿȯĘ÷ĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£ŹżĻąĶ¬£¬ŅŅÖŠĘ½ŗāŹ±·Å³öČČĮæĪŖ78.8kJ£¬ÓÉ2SO2£Øg£©+O2£Øg£©2SO3£Øg£©”÷H=-197kJmol-1æÉÖŖ£¬²Ī¼Ó·“Ó¦µÄ¶žŃõ»ÆĮņĪŖ2mol”Į![]()
=0.8mol£¬Ōņ¶žŃõ»ÆĮņÅØ¶Č±ä»ÆĮæĪŖ![]() =0.4mol/L£¬SO2”¢O2”¢SO3µÄĘšŹ¼ÅØ¶Č·Ö±šĪŖ
=0.4mol/L£¬SO2”¢O2”¢SO3µÄĘšŹ¼ÅØ¶Č·Ö±šĪŖ![]()
=0.9mol/LӢ![]() =0.45mol/LӢ
=0.45mol/L”¢![]() =0.1mol/L£¬Ōņ£ŗ
=0.1mol/L£¬Ōņ£ŗ
2SO2£Øg£©+O2£Øg£©2SO3£Øg£©
ĘšŹ¼£Ømol/L£©£ŗ0.9 0.45 0.1
×Ŗ»Æ£Ømol/L£©£ŗ0.4 0.2 0.4
Ę½ŗā£Ømol/L£©£ŗ0.5 0.25 0.5
¹ŹĘ½ŗā³£ŹżK=![]() =4£¬¹ŹB“ķĪó£»
=4£¬¹ŹB“ķĪó£»
C.øł¾ŻBÖŠ¼ĘĖćæÉÖŖ£¬ŅŅÖŠĘ½ŗāŹ±¶žŃõ»ÆĮņĪļÖŹµÄĮæĪŖ1.8mol-0.8mol=1mol£¬¼×ÖŠ²Ī¼Ó·“Ó¦¶žŃõ»ÆĮņĪŖ2mol-1mol=1mol£¬¼×ÖŠ¶žŃõ»ÆĮņµÄ×Ŗ»ÆĀŹ![]() ”Į100%=50%£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬SO2µÄ×Ŗ»ÆĀŹ½«Š”ÓŚ50%£¬¹ŹC“ķĪó£»
”Į100%=50%£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬SO2µÄ×Ŗ»ÆĀŹ½«Š”ÓŚ50%£¬¹ŹC“ķĪó£»
D.ŅŅČŻĘ÷ÖŠµÄ·“Ó¦¾tmin“ļµ½Ę½ŗā£¬Ōņ0”«tminÄŚ£¬v£ØO2£©=![]() =
=![]() mol/£ØLmin£©£¬¹ŹDÕżČ·£»
mol/£ØLmin£©£¬¹ŹDÕżČ·£»
“š°ø£ŗD


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻæÉĄūÓĆČēĶ¼ĖłŹ¾µē½ā×°ÖĆĪüŹÕŗĶ×Ŗ»Æ![]() (A,B¾łĪŖ¶čŠŌµē¼«)”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
(A,B¾łĪŖ¶čŠŌµē¼«)”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
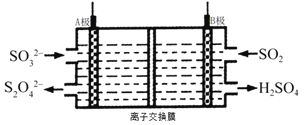
A. Bµē¼«ĪŖµē½ā³ŲµÄŅõ¼«
B. B¼«ĒųĪüŹÕ5mo1 ![]() £¬ŌņA¼«ĒųÉś³É2.5mo1
£¬ŌņA¼«ĒųÉś³É2.5mo1 ![]()
C. B¼«Ēųµē½āŅŗĪŖĻ”ĮņĖį£¬µē½āŅ»¶ĪŹ±¼äŗóĮņĖįÅضČŌö“ó
D. Aµē¼«µÄµē¼«·“Ó¦ĪŖ: ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŠæ”ŖæÕĘųČ¼ĮĻµē³ŲÓŠ±ČÄÜĮæøß”¢ČŻĮæ“ó”¢Ź¹ÓĆŹŁĆü³¤µČÓÅµć£¬æÉÓĆ×÷µē¶Æ³µ¶ÆĮ¦µēŌ“£¬µē³ŲµÄµē½āÖŹČÜŅŗĪŖ KOH ČÜŅŗ£¬·ÅµēŹ±·¢Éś·“Ó¦£ŗ2Zn + O2+4OH-+2H2O= 2[Zn(OH)4]2-”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£ŗ
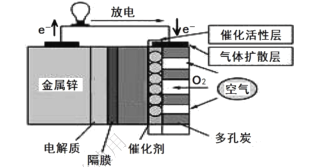
A.·ÅµēŹ±£¬øŗ¼«·“Ó¦ĪŖ Zn-2e- = Zn2+
B.øĆøōĤĪŖŃōĄė×Ó½»»»Ä¤£¬ŌŹŠķK+Ķعż
C.³äµēŹ±£¬µ± 0.1 molO2 Éś³ÉŹ±£¬Į÷¾µē½āÖŹČÜŅŗµÄµē×ÓøöŹżŌ¼ĪŖ 1.204”Į1022
D.²ÉÓƶąæ×ĢææÉĢįøßµē¼«Óėµē½āÖŹČÜŅŗµÄ½Ó“„Ć껿£¬²¢ÓŠĄūÓŚŃõĘųĄ©É¢ÖĮµē¼«±ķĆę
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°ŠÄµĆ°²”±ŹĒÖŹĮĻŠÄŌą²”µÄŅ©Īļ£¬ĻĀĆęŹĒĖüµÄŅ»ÖÖŗĻ³ÉĀ·ĻߣؾßĢå·“Ó¦Ģõ¼žŗĶ²æ·ÖŹŌ¼ĮĀŌ£©£ŗ
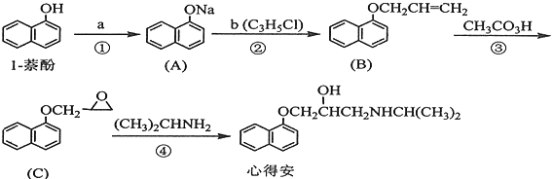
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŹŌ¼ĮaŹĒ____________£¬ŹŌ¼ĮbµÄ½į¹¹¼ņŹ½ĪŖ______________,bÖŠ¹ŁÄÜĶŵÄĆū³ĘŹĒ_______________”£
£Ø2£©¢ŪµÄ·“Ó¦ĄąŠĶŹĒ____________________”£
£Ø3£©ŠÄµĆ°²µÄ·Ö×ÓŹ½ĪŖ_______________-”£
£Ø4£©ŹŌ¼ĮbæÉÓɱūĶé¾Čż²½·“Ó¦ŗĻ³É£ŗ
![]()
·“Ó¦1µÄŹŌ¼ĮÓėĢõ¼žĪŖ_______________£¬·“Ó¦2µÄ»Æѧ·½³ĢŹ½ĪŖ_______________£¬·“Ó¦3µÄ·“Ó¦ĄąŠĶŹĒ_______________”£(ĘäĖūŗĻĄķ“š°øŅ²æÉ)
£Ø5£©·¼Ļć»ÆŗĻĪļDŹĒ1-ŻĮ(·Ó)µÄĶ¬·ÖŅģ¹¹Ģ壬Ęä·Ö×ÓÖŠÓŠĮ½øö¹ŁÄÜĶÅ£¬ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬DÄܱ»KMnO4ĖįŠŌČÜŅŗŃõ»Æ³ÉE(C2H4O2)ŗĶ·¼Ļć»ÆŗĻĪļF(C8H6O4)£¬ EŗĶFÓėĢ¼ĖįĒāÄĘČÜŅŗ·“Ó¦¾łÄܷųöCO2ĘųĢå,F·¼»·ÉĻµÄŅ»Ļõ»Æ²śĪļÖ»ÓŠŅ»ÖÖ”£DµÄ½į¹¹¼ņŹ½ĪŖ_______________ £»ÓÉFÉś³ÉŅ»Ļõ»Æ²śĪļµÄ»Æѧ·½³ĢŹ½ĪŖ_______________£¬øĆ²śĪļµÄĆū³ĘŹĒ_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬·“Ó¦H2(g)+CO2(g)![]() H2O(g)+CO(g)µÄĘ½ŗā³£ŹżK=
H2O(g)+CO(g)µÄĘ½ŗā³£ŹżK=![]() ”£øĆĪĀ¶ČĻĀ£¬ŌŚ¼×”¢ŅŅ”¢±ūČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėH2(g)ŗĶCO2(g)£¬ĘäĘšŹ¼ÅضČČē±ķĖłŹ¾£ŗ
”£øĆĪĀ¶ČĻĀ£¬ŌŚ¼×”¢ŅŅ”¢±ūČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėH2(g)ŗĶCO2(g)£¬ĘäĘšŹ¼ÅضČČē±ķĖłŹ¾£ŗ
¼× | ŅŅ | ±ū | |
c(H2)/(mol”¤L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol”¤L-1) | 0.010 | 0.010 | 0.020 |
ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ( )
A. ·“Ó¦æŖŹ¼Ź±£¬±ūČŻĘ÷ÖŠ»Æѧ·“Ó¦ĖŁĀŹ×ī“󣬼×ČŻĘ÷ÖŠ»Æѧ·“Ó¦ĖŁĀŹ×īŠ”
B. Ę½ŗāŹ±£¬ŅŅČŻĘ÷ÖŠCO2µÄ×Ŗ»ÆĀŹ“óÓŚ60%
C. Ę½ŗāŹ±£¬¼×ČŻĘ÷ÖŠŗĶ±ūČŻĘ÷ÖŠH2µÄ×Ŗ»ÆĀŹ¾łŹĒ60%
D. Ę½ŗāŹ±£¬±ūČŻĘ÷ÖŠc(CO2)ŹĒ¼×ČŻĘ÷ÖŠµÄ2±¶£¬ŹĒ 0.012 mol”¤L-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤Ņµ·ĻĘų”¢Ęū³µĪ²ĘųÅŷųöµÄNOx”¢SO2µČ£¬ŹĒŠĪ³ÉĪķö²µÄÖ÷ŅŖĪļÖŹ£¬Ęä×ŪŗĻÖĪĄķŹĒµ±Ē°ÖŲŅŖµÄŃŠ¾ææĪĢā”£
£Ø1£©ŅŃÖŖ£ŗ¢ŁCOČ¼ÉÕČȵĔ÷H1=£283.0kJ”¤mol-l£¬¢ŚN2(g)+O2(g) ![]() 2NO(g) ”÷H2=+180.5kJ”¤mol-1£¬Ęū³µĪ²ĘųÖŠµÄNO(g)ŗĶCO(g)ŌŚŅ»¶ØĪĀ¶ČŗĶ“߻ƼĮĢõ¼žĻĀæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ2NO(g)+2CO(g)
2NO(g) ”÷H2=+180.5kJ”¤mol-1£¬Ęū³µĪ²ĘųÖŠµÄNO(g)ŗĶCO(g)ŌŚŅ»¶ØĪĀ¶ČŗĶ“߻ƼĮĢõ¼žĻĀæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)£» ”÷H=___”£
N2(g)+2CO2(g)£» ”÷H=___”£
£Ø2£©½«0£®20mol NOŗĶ0£®10molCO³äČėŅ»øöČŻ»żŗć¶ØĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬·“Ó¦¹ż³ĢÖŠ²æ·ÖĪļÖŹµÄÅØ¶Č±ä»ÆČēĻĀĶ¼ĖłŹ¾£®
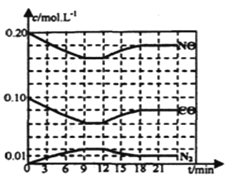
¢ŁøĆ·“Ó¦µŚŅ»“Ī“ļµ½Ę½ŗāŹ±µÄĘ½ŗā³£ŹżĪŖ________”£
¢ŚµŚ12minŹ±øıäµÄĢõ¼žŹĒ________”£
¢ŪŌŚµŚ24minŹ±£¬Čō±£³ÖĪĀ¶Č²»±ä£¬ŌŁĻņČŻĘ÷ÖŠ³äČėCOŗĶN2ø÷0£®060mol£¬Ę½ŗā½«________ŅʶÆ(Ģī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±)£®
(3)SNCR-SCRĶŃĻõ¼¼ŹõŹĒŅ»ÖÖŠĀŠĶµÄ³żČ„ŃĢĘųÖŠµŖŃõ»ÆĪļµÄĶŃĻõ¼¼Źõ£¬Ņ»°ć²ÉÓĆ°±Ęų»ņÄņĖŲ”£
¢ŁSNCRĶŃĻõ¼¼ŹõÖŠ£ŗŌŚ“߻ƼĮ×÷ÓĆĻĀÓĆNH3×÷»¹Ō¼Į»¹ŌNO£¬ĘäÖ÷ŅŖ·“Ó¦ĪŖ£ŗ4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)£¬”÷H<0”£ĢåĻµĪĀ¶ČÖ±½ÓÓ°ĻģSNCR¼¼ŹõµÄĶŃĻõŠ§ĀŹ£¬ČēĶ¼ĖłŹ¾”£µ±ĢåĻµĪĀ¶ČŌ¼ĪŖ925”ꏱ£¬SNCRĶŃĻõŠ§ĀŹ×īøߣ¬ĘäæÉÄܵÄŌŅņŹĒ________”£
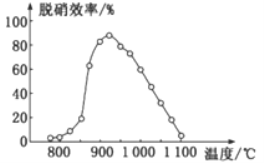
¢ŚSCRĶŃĻõ¼¼ŹõÖŠŌņÓĆÄņĖŲ[CO(NH2)2]×÷»¹Ō¼Į»¹ŌNO2µÄ»Æѧ·½³ĢŹ½ĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅĄūÓĆČēĶ¼×°ÖĆĢ½¾æSO2»¹ŌCuO£¬²¢½ųŅ»²½¼ģ²ā²śĪļŗ¬Į攣»Ų“šĻĀĮŠĻą¹ŲĪŹĢā£ŗ
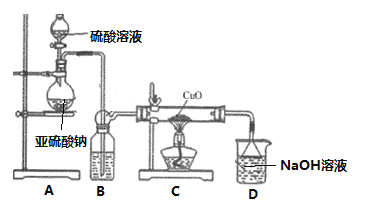
¢ń. SO2»¹ŌCuOĢ½¾æ
(1)×°ÖĆAÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½_______________________________________”£
(2)ŌŚÖĘČ”SO2Ź±£¬Ź¹ÓĆH2SO4ČÜŅŗµÄÅضČĪŖ__________Ź±£ØĢīŠņŗÅ£¬“ÓĻĀĮŠÅضČ֊єȔ£©£¬ÖʱøSO2µÄĖŁĀŹĆ÷ĻŌæģ”£Ēė½āŹĶ²»Ń”ĻĀĮŠĘäĖüÅضČĮņĖįµÄŌŅņ____________________”£
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)³ä·Ö·“Ó¦ŗó£¬ŗŚÉ«¹ĢĢå±äĪŖŗģÉ«”£Č”CÖŠŹŹĮæµÄ²śĪļ£¬¼ÓĖ®ŗóČÜŅŗĻŌĄ¶É«²¢ÓŠŗģÉ«³ĮµķĪļ£¬Č”ŗģÉ«³ĮµķĪļµĪ¼ÓŃĪĖį£¬ČÜŅŗÓÖ³ŹĻÖĄ¶É«²¢ČŌÓŠÉŁĮæŗģÉ«²»ČÜĪļ£¬ÓÉ“ĖæÉŅŌµĆ³ö£ŗ
¢ŁŅŃÖŖSO2ÓėCuO·“Ӧɜ³ÉĮ½ÖÖ²śĪļ£¬Š“³öøĆ»Æѧ·½³ĢŹ½___________________________”£
¢ŚČ”ŗģÉ«³ĮµķĪļµĪ¼ÓŃĪĖį£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½______________________________________”£
¢ņ£®Éś³ÉĪļÖŠCuSO4ŗ¬Įæ¼ģ²ā
(4)ÓĆ”°µāĮæ·Ø”±²ā¶Ø²śĪļÖŠCuSO4ŗ¬Įæ”£Č”m g¹ĢĢåČܽāÓŚĖ®ÅäÖĘ³É100mLČÜŅŗ£¬Č”20.00mLČÜŅŗµĪ¼Ó¼øµĪĻ”ĮņĖį£¬ŌŁ¼ÓČė¹żĮæKIČÜŅŗ£¬ŅŌµķ·ŪĪŖÖøŹ¾¼ĮÓĆNa2S2O3±ź×¼ČÜŅŗµĪ¶Ø£¬Ļą¹Ų»Æѧ·“Ó¦ĪŖ2Cu2++4I£=2CuI”ż+I2£¬I2+I£![]() I3££¬I2+2S2O32£=S4O62£+2I£”£
I3££¬I2+2S2O32£=S4O62£+2I£”£
¢ŁČōĻūŗÄ0.1000mol/L Na2S2O3±ź×¼ČÜŅŗVmL£¬Ōņ²śĪļÖŠCuSO4ÖŹĮæ·ÖŹżĪŖ____________”£
¢ŚCuI³ĮµķĪļ¶ŌI3”Ŗ¾ßÓŠĒæµÄĪüø½ÄÜĮ¦£¬ÓÉ“Ė»įŌģ³ÉCuSO4ÖŹĮæ·ÖŹż²ā¶ØÖµ_______£ØĢī”°Ę«“ó”±»ņ”°Ę«Š””±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĀŠĶæɳäµēµē³Ų£¬Äܳ¤Ź±¼ä±£³ÖĪČ¶ØµÄ·ÅµēµēŃ¹”£øƵē³ŲµÄ×Ü·“Ó¦Ź½ČēĻĀ£¬ŅŌĻĀĖµ·Ø²»ÕżČ·µÄŹĒ(”””” )
3Zn£«2K2FeO4£«8H2O![]() 3Zn(OH)2£«2Fe(OH)3£«4KOH
3Zn(OH)2£«2Fe(OH)3£«4KOH
A.·ÅµēŹ±Ćæ×ŖŅĘ3 molµē×Ó£¬Õż¼«ÓŠ1 mol K2FeO4±»Ńõ»Æ
B.·ÅµēŹ±Õż¼«·“Ó¦Ź½ĪŖFeO42-£«4H2O£«3e£=Fe(OH)3£«5OH£
C.·ÅµēŹ±øŗ¼«·“Ó¦Ź½ĪŖZn£2e££«2OH£=Zn(OH)2
D.³äµēŹ±Ńō¼«ø½½üµÄČÜŅŗµÄ¼īŠŌ¼õČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æI£®Ä³Ń§ÉśÓĆ0.100molL-1µÄKOH±ź×¼ČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį£¬Ęä²Ł×÷æÉ·Ö½āĪŖČēĻĀ¼ø²½£ŗ
A£®ŅĘČ”20mL“ż²āŃĪĖįČÜŅŗ×¢Čė½ą¾»µÄ׶ŠĪĘæÖŠ£¬²¢¼ÓČė2”«3µĪ·ÓĢŖ£»
B£®ÓƱź×¼ČÜŅŗČóĻ“µĪ¶Ø¹Ü2”«3“Ī£»
C£®°ŃŹ¢ÓŠ±ź×¼ČÜŅŗµÄ¼īŹ½µĪ¶Ø¹Ü¹Ģ¶ØŗĆ£¬µ÷½ŚµĪ¶Ø¹ÜŹ¹¼ā×ģ“¦³äĀśČÜŅŗ£»
D£®Č”±ź×¼KOHČÜŅŗ×¢Čė¼īŹ½µĪ¶Ø¹ÜÖĮæĢ¶Č”°0”±ŅŌÉĻ2”«3cm “¦£»
E£®µ÷½ŚŅŗĆęÖĮ”°0”±»ņ”°0”±ŅŌĻĀæĢ¶Č£¬¼ĒĻĀ¶ĮŹż£»
F£®°Ń׶ŠĪĘæ·ÅŌŚµĪ¶Ø¹ÜµÄĻĀĆę£¬ÓƱź×¼KOHČÜŅŗµĪ¶ØÖĮÖÕµć²¢¼ĒĻĀµĪ¶Ø¹ÜŅŗĆęµÄæĢ¶Č”£
ŹµŃ鱹ŗÅ | KOHČÜŅŗµÄÅØ¶Č£Ømol/L£© | µĪ¶ØĶź³ÉŹ±£¬KOHČÜŅŗµĪČėµÄĢå»ż£ØmL£© | “ż²āŃĪĖįČÜŅŗµÄĢå»ż£ØmL£© |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
¾Ķ“ĖŹµŃéĶź³ÉĢīæÕ£ŗ
£Ø1£©ÕżČ·²Ł×÷²½ÖčµÄĖ³ŠņŹĒ£ØÓĆŠņŗÅ×ÖÄøĢīŠ“£©_____”£
£Ø2£©øł¾ŻÉĻŹöŹż¾Ż£¬æɼĘĖć³öøĆŃĪĖįµÄÅضČŌ¼ĪŖ_____£Ø±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©
II£®ŃĒĮņĖįŃĪŹĒŅ»ÖÖ³£¼ūŹ³Ę·Ģķ¼Ó¼Į”£ĪŖ¼ģŃéijŹ³Ę·ÖŠŃĒĮņĖįŃĪŗ¬Įæ(Ķس£ŅŌ1kgѳʷ֊ŗ¬SO2µÄÖŹĮæ¼Ę)£¬Ä³ŃŠ¾æŠ”×éÓĆ”°µāŃõ»Æ»¹ŌµĪ¶Ø·Ø”±½ųŠŠ²ā¶Ø£¬ŹµŃéĮ÷³ĢČēĻĀ£ŗ
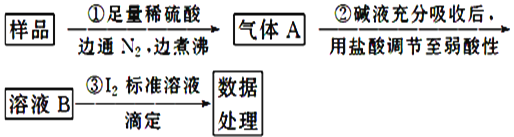
£Ø1£©µā±ź×¼ŅŗӦєÓĆ____(Ģī”°ĖįŹ½”±»ņ”°¼īŹ½”±)µĪ¶Ø¹ÜŹ¢×°£¬¼Ó×¢±ź×¼ŅŗÖ®Ē°±ŲŠė¶ŌµĪ¶Ø¹Ü½ųŠŠ²éĀ©”¢Ļ“µÓ”¢____”£
£Ø2£©×¶ŠĪĘæÄŚµÄÖøŹ¾¼ĮĪŖ_____£¬ÅŠ¶Ļ“ļµ½µĪ¶ØÖÕµćµÄŅĄ¾ŻŹĒ________”£
£Ø3£©ĻĀĮŠ²Ł×÷»įŹ¹²ā¶Ø½į¹ūĘ«“óµÄÓŠ_______
A£®ĘšŹ¼¶ĮŹżŹ±Ę½ŹÓ£¬ÖÕµć¶ĮŹżŹ±ø©ŹÓ
B£®Ī“ÓƱź×¼ŅŗČóĻ“µĪ¶Ø¹Ü
C£®²½Öč¢ŁÖŠÓĆĻ”ŃĪĖį“śĢęĻ”ĮņĖį
£Ø4£©ČōȔѳʷw g£¬°“ŅŅ·½°ø²āµĆĻūŗÄ0.01000mol”¤L-1 I2ČÜŅŗVmL£¬Ōņ1kgѳʷ֊ŗ¬SO2µÄÖŹĮæŹĒ____g(ÓĆŗ¬w”¢VµÄ“śŹż )”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com