
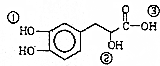
| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
分析 由结构可知分子式,分子中含酚-OH、醇-OH、-COOH,结合酚、醇、羧酸的性质来解答.
解答 解:A.由结构可知该有机物的分子式为C9H10O5,故A正确;
B.含-OH、-COOH可发生缩聚反应,-OH可发生消去、氧化反应,苯环可发生加成反应,故B正确;
C.只有酚-OH与-COOH与NaOH反应,则1mol该有机物最多可以和3molNaOH发生反应,故C错误;
D.-COOH与Na反应最剧烈,Na与醇反应最慢,则该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、醇、羧酸的性质,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
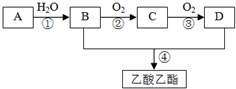 A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;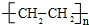 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
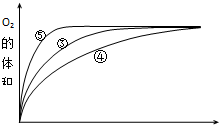
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片、石墨棒,乙醇 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、铂片,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
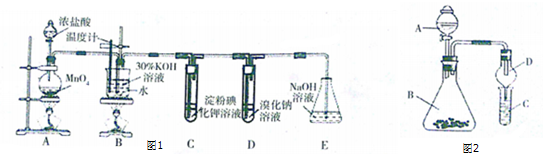
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸可以用于除去锅炉或水壶中的水垢 | |
| B. | 切开的苹果放置后变色和纸张久置后变黄的原理相同 | |
| C. | 蜂蚁蛰咬人时会向人体注入酸性物质,可涂抹小苏打溶液缓解疼痛 | |
| D. | 工业含酸废水可用氢氧化钡溶液处理后再排放,有利于减少水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}$C | |
| B. | 硫离子的结构示意图: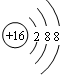 | |
| C. | 氢氧化钠的电子式: | |
| D. | 氮气分子的电子式: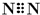 , , |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
| B | 浓硫酸 | 蔗糖 | 品红 | 浓硫酸有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 生成BaSO3白色沉淀 | |
| D | 醋酸 | Na2CO3 | 苯酚钠溶液 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com