
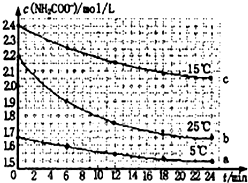
 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| △c |
| △t |
| 2.2mol/L-1.9mol/L |
| 6min |


科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(H+)降低 |
| B、向水中加入少量固体醋酸钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| 一定条件 |
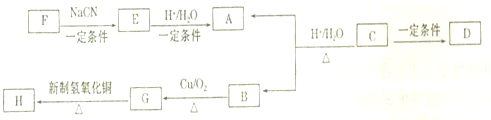
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置是某种气体X的制取装置和收集装置(必要时可加热),所用试剂从下列试剂中选取2~3种,:
如图装置是某种气体X的制取装置和收集装置(必要时可加热),所用试剂从下列试剂中选取2~3种,:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、难溶电解质都是弱电解质 |
| B、难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| C、在白色ZnS沉淀上滴加CuSO4溶液,沉淀变黑色,说明CuS比ZnS更难溶于水 |
| D、相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
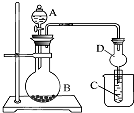
| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛氯化钙溶液,则C中溶液变浑浊 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、实验仪器D可以起到防止溶液倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:  | ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:  |
查看答案和解析>>
科目:高中化学 来源: 题型:
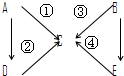 如图表示A-E五种含氮物质相互转化的关系图.其中A、B、C、D常温下都是气体,B为红棕色.
如图表示A-E五种含氮物质相互转化的关系图.其中A、B、C、D常温下都是气体,B为红棕色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com