


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
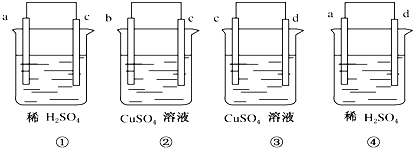
| A、d>a>c>b |
| B、b>d>c>a |
| C、d>c>a>b |
| D、a>d>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.
现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.| A是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离分别是:I1=738kJ?mol-1 I2=1451kJ?mol-1 I3=7733kJ?mol-1 I4=10540kJ?mol-1 |
| D原子核外所有p轨道全充满或半充满 |
| E元素基态原子的核外电子排布为1s22s22p63s23p5 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第8列 |
| H元素原子价电子排布式为3d104s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
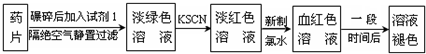
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol某粒子集体所含该粒子数与0.012kg12C中所含碳原子数相同 |
| B、1mol任何粒子的粒子数叫做阿伏加德罗常数,通常表示为6.02×1023mol-1 |
| C、O22-的摩尔质量为34g/mol |
| D、常温常压下28g N2所含分子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol O2 的质量为 32 g/mol |
| B、SO42-的摩尔质量是 96 g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量是44 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com