
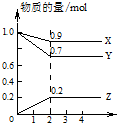
 某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.由图中数据分析.
某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.由图中数据分析.分析 (1)由物质的量随时间的变化曲线图可知,平衡时Y的物质的量为0.7mol,结合c=$\frac{n}{V}$计算;
(2)反应开始至2min,Z的物质的量增多0.2mol,结合v=$\frac{△c}{△t}$计算;
(3)由图可知,2min内X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,结合物质的量的变化量之比等于化学计量数之比确定化学方程式.
解答 解:(1)由物质的量随时间的变化曲线图可知,平衡时Y的物质的量为0.7mol,则c=$\frac{n}{V}$=$\frac{0.7mol}{2L}$=0.35mol/L,
故答案为:0.35mol/L;
(2)反应开始至2min,Z的物质的量增多0.2mol,则v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(3)由图可知,2min内X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,
X、Y、Z的物质的量变化量之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,
由物质的量的变化量之比等于化学计量数之比,且2min时达到化学平衡,则化学反应方程式为X+3Y?2Z,
故答案为:X+3Y?2Z.
点评 本题考查物质的量随时间变化曲线及计算,为高频考点,把握图中物质的量变化、速率和浓度计算等为解答的关键,侧重分析与计算能力的考查,注意判断2min时反应达到平衡状态,题目难度不大.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
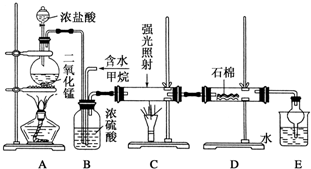
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
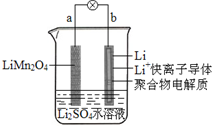
| A. | a为电池的正极 | B. | 放电时,电子由b极流向a极 | ||
| C. | 充电时,a极发生还原反应 | D. | 放电时,溶液中的Li+从b向a迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 H2SiO3<H3PO4<H2SO4 | B. | 碱性 Ca(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性SiH4>NH3>H2O>HF | D. | 原子半径大小:Na>S>O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$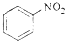 +H2O +H2O | |
| B. | CH2═CH2+Br2→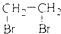 | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2 $\stackrel{光}{→}$ CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、Ba2+、I- | B. | AlO2-、S2-、PO43-、Na+ | ||
| C. | Fe2+、Cu2+、Mg2+、NO3- | D. | NH4+、Fe3+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)是一种常见有机物,有重要的应用.
甲醇(CH3OH)是一种常见有机物,有重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com