
【题目】铝热法是铝与某些金属氧化物反应获得高熔点金属单质的方法。工业上可用于制造无碳或低碳铁合金。铝粉和赤铁矿发生铝热反应的化学方程式为:Fe2O3+2Al![]() 2Fe+Al2O3
2Fe+Al2O3
(1)上述反应中,作为还原剂的物质是__(化学式),化合价降低的元素是__(名称)。
(2)若反应中消耗了0.2mol Al,生成Fe的物质的量为__mol,转移电子的物质的量为__mol。
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】在中学化学实验中研究和推广微量化实验符合绿色化学原则。下列对微量化实验装置图的解读不正确的是( )
A.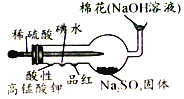 二氧化硫性质的组合实验装置。将稀硫酸挤入干燥管胖肚中,则前端小凹槽内三种溶液均能褪色。
二氧化硫性质的组合实验装置。将稀硫酸挤入干燥管胖肚中,则前端小凹槽内三种溶液均能褪色。
B.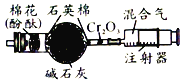 氨的催化合成装置。将注射器内的氮气和氢气缓缓通过加热的催化剂,即可观察到蘸有酚酞溶液的棉团变红。
氨的催化合成装置。将注射器内的氮气和氢气缓缓通过加热的催化剂,即可观察到蘸有酚酞溶液的棉团变红。
C.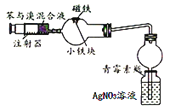 苯与液溴反应的装置。反应发生后,青霉素小瓶中产生黄色沉淀,证明该反应为取代反应。
苯与液溴反应的装置。反应发生后,青霉素小瓶中产生黄色沉淀,证明该反应为取代反应。
D.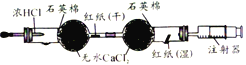 氯气的制备与漂白装置。前端凹槽内放入高锰酸钾固体,滴入浓盐酸后,干燥的红纸不退色,湿润的红纸退色。
氯气的制备与漂白装置。前端凹槽内放入高锰酸钾固体,滴入浓盐酸后,干燥的红纸不退色,湿润的红纸退色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______________。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________________________;制铝时,电解Al2O3而不电解AlCl3的原因是_________________________________________。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
写出SiCl4的电子式:____________;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是_______。
a. NH3b. HI c. SO2d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.防止FeCl2溶液变质而加入Fe粉:2Fe3++Fe=3Fe2+
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如右图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3恰好反应时,消耗Na、NaOH、Na2CO3的物质的量之比是
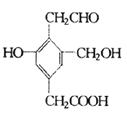
A.3:3:2B.6:4:3C.1:1:1D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图。根据上述产业流程回答下列问题:

(1)从原料、能源、交通角度考虑该企业应建在______
A西部山区 B沿海地区 C发达城市 D东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①______、②______、③______、④______、⑤______。
(3)沸腾炉发生反应的化学方程式:______;磷肥厂的主要产品是普钙,其主要成分是______(填化学式)。
(4)热电厂的冷却水是______,该流程中浓缩盐水除提取盐以外还可提取的物质有______(写出一种即可)。
(5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。______,______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)4NO2(g)+O2(g)△H>0.T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
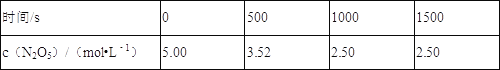
下列说法正确的是( )
A.500_s内NO2的生成速率为2.96×10﹣3_molL﹣1s﹣1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡其他条件不变,将容器的体积压缩到原来1/2,则c(N2O5)<5.00molL﹣
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=8 mol·L-1·min-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是( )
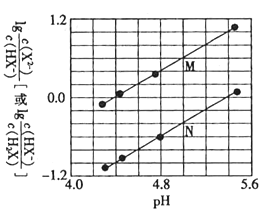
A.Ka1(H2X)的数量级为![]()
B.曲线N表示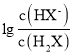 与pH的变化关系
与pH的变化关系
C.NaHX溶液中:c(H+)<c(OH-)
D.当混合物呈中性时,c(Na+)>c(X2-)>c(HX-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com