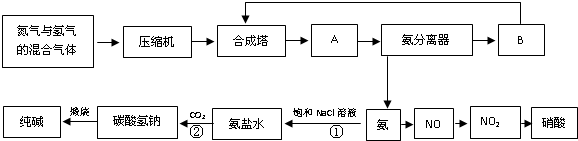
解:(1)沉淀剂A源于石灰窑,说明其是生石灰或熟石灰;粗盐中的镁离子一般用碱除去,钙离子一般用碳酸钠除去,故答案为:Na
2CO
3;
(2)①操作过程,相氨化后饱和食盐水中通入二氧化碳发生反应生成碳酸氢钠,所以a接d,b接e,f接c,故答案为:d,e,
②向氨化后饱和食盐水中通入二氧化碳发生反应生成碳酸氢钠和NH
4Cl:NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl,故答案为:NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl;
③检验氨气的方法:蘸有浓盐酸的玻璃棒遇氨气有白烟生成;氨气遇到湿润的红色石蕊试试纸变蓝,故答案为:用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量;
(3)假设加热前纯碱的质量为m g,加热后的质量为n g,则加热损失的质量为:m-n,则纯碱中碳酸氢钠的质量为:84(m-n)/31;故纯碱中含有的碳酸氢钠的质量分数为

,故答案为:

;
(4)A.0.1mol/L NH
4Cl溶液中导电粒子的种类都有3种:Cl
-、NH
4+、H
+,混合溶液中导电粒子的种类都有3种:Cl
-、NH
4+、0H
-,Cl
-、NH
4+、H
+,但NH
4+的数目不等,故a错误;
b.铵根离子的水解能力大于氨水的电离能力,混合后的溶液中,c(NH
3?H
2O)>c(Cl
-)>c(NH
4+)>c(OH
-)>c(H
+),故b错误;
c.0.1mol/LNH
3?H
2O溶液和0.1mol/LNH
4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,说明铵根离子的水解能力小于氨水的电离能力,故c正确;
d.0.1mol/LNH
3?H
2O溶液显碱性和0.1mol/LNH
4Cl溶液显酸性,铵根离子的水解能力小于氨水的电离能力,混合前两份溶液的pH之和大于14,故d正确;
故选:cd;
分析:(1)根据题意A源于石灰窑,说明其是生石灰或熟石灰且沉淀剂A、B除杂质来分析;
(2)①根据操作过程,向氨化后饱和食盐水中通入二氧化碳发生反应生成碳酸氢钠;
②根据操作过程,向氨化后饱和食盐水中通入二氧化碳发生反应生成碳酸氢钠和NH
4Cl;
③根据检验氨气的方法;
(3)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质运用差量法来解答来回答;
(4)A.0.1mol/L NH
4Cl溶液中导电粒子的种类都有3种:Cl
-、NH
4+、H
+,混合溶液中导电粒子的种类都有3种:Cl
-、NH
4+、0H
-,Cl
-、NH
4+、H
+,但NH
4+的数目不等;
b.铵根离子的水解能力大于氨水的电离能力,混合后的溶液中,c(NH
3?H
2O)>c(Cl
-)>c(NH
4+)>c(OH
-)>c(H
+)
c.0.1mol/LNH
3?H
2O溶液和0.1mol/LNH
4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,说明铵根离子的水解能力小于氨水的电离能力;
d.0.1mol/LNH
3?H
2O溶液显碱性和0.1mol/LNH
4Cl溶液显酸性,铵根离子的水解能力小于氨水的电离能力,混合前两份溶液的pH之和大于14.
点评:此题考查了物质的提纯、化学实验基本操作、离子浓度的比较,难度不大,根据课本知识即可解答.

 滤液
滤液 滤渣
滤渣 纯碱
纯碱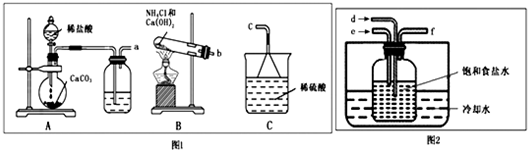
 ,故答案为:
,故答案为: ;
;


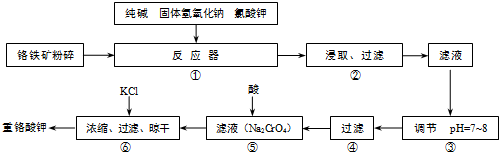
 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀