
(1)图甲是实验室常用的一种仪器,其名称是________;其主要用途是________________________________________________________________________。
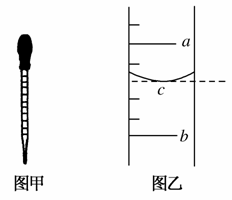
(2)小明用某规格的量筒量取一定体积的液体,液面位置如图乙,则其量得的液体体积为________(用a、b来表示)。

(3)图丙是某研究性小组设计的一个储气装置。
①将气体存于Ⅱ瓶中,下列说法不正确的是________。
A.打开止水夹a和b,将气体从导管d通入,可将气体储存在Ⅱ瓶中
B.作为储气或取气时都无需在c处安装止水夹
C.该装置主要缺陷是c导管上未装止水夹
D.该装置也可用作制取氢气的发生装置
②要从该储好气的装置中取用气体,正确操作是________________________________________________________________________。
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,保持体系内温度800 ℃不变,将一定量的NO和O2混合发生反应:2NO+O2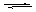 2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示。请回答下列问题。
2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示。请回答下列问题。
(1)30 s时反应达到平衡,用O2表示达到平衡过程的平均反应速率为
________,图像中曲线________(选填“Ⅰ”或“Ⅱ”)表示NO2的变化。由图像中曲线和数据变化,能否计算该温度下的平衡常数:____________(填“能”或“不能”)。
(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(3)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
(4)上述800 ℃时的反应达到平衡时测得放出热量a kJ。试写出在此条件下NO与氧气反应的热化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将质量相同的四份Cu粉,分别置于过量的下列酸里,产生气体的物质的量最多的是( )
A.稀H2SO4 B.浓H2SO4
C.稀HNO3 D.浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列转化关系中,B、D都是淡黄色固体,且D和A都是单质。
(1)写出下列物质的化学式:A__________,G__________,H__________。
(2)写出E→F,F→G的化学方程式:
E→F________________________________________________________________________;
F→G________________________________________________________________________。
(3)写出E和足量的C溶液反应的离子方程式____________________。
(4)0.5千克含D 48%的某物质能转化为含G 98%的溶液多少千克(所含的D有98%转化为G)?
查看答案和解析>>
科目:高中化学 来源: 题型:
安全是顺利进行实验的保障,下列实验处理或方法正确的是( )
A.尾气(主要含氯气)用澄清石灰水吸收较好
B.把氢气和氯气混合光照制氯化氢
C.导管口点燃一氧化碳时也要验纯
D.重金属盐有毒,如果不慎食入氯化钡,喝硫酸铜溶液即可
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可行或叙述正确的是( )
①不能用闻气味的方法区分丝织品和棉织物
②蔗糖加稀硫酸的水解液,再加新制Cu(OH)2悬浊液共热会产生砖红色沉淀
③乙酸乙酯、油脂在碱性条件下水解均可制肥皂
④用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
⑤金属的冶炼都是置换反应
⑥漂白粉、玻璃、脂肪是混合物,水银、明矾、蔗糖是纯净物
⑦盐酸、BaSO4是强电解质,氨水是弱电解质,苯、四氯化碳是非电解质
⑧符合n(C):n(H)=n:(2n+2)的物质一定是烷烃
⑨煤中含苯及甲苯,可以用先干馏后分馏的方法把它们分离出来
⑩离子键只存在于离子化合物中,共价键只存在于共价化合物和离子化合物中.
|
| A. | ⑤⑥⑧⑨⑩ | B. | ①⑥ | C. | ①⑤⑥⑨⑩ | D. | ②③⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑可用于地下水脱氮,实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5mol/L盐酸中进行预处理.
Ⅱ、30min后,用去离子水反复冲洗,至冲洗后液体的pH为中性.在N2保护下烘干备用.
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液.
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中.
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 .
(2)烘干时需要在N2保护下进行的原因是 .
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 .
(4)将酸性条件下,铁与NO3﹣反应的离子方程式补充完整:
Fe+ NO3﹣+ + ═ Fe2++ NH4++ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修3物质结构与性质】(15分)
A、B、C、D、E、F为周期表中前四周期的六种元素,它们的原子序数依次增大,且均不同族。A、B、C三种元素的基态原子具有相同的能层和能级,且第一电离能I1(A)<I1(C)<I1(B),BC2+与AC2互为等电子体;D、E为同周期相邻元素;F元素位于周期表中1~18列中的第11列。请回答下列问题(答题时请用相应的元素符号表示相应元素):
⑴A元素的价层电子排布图为 ;BC2+的电子式为 ;
基态F原子的核外电子排布简式 。
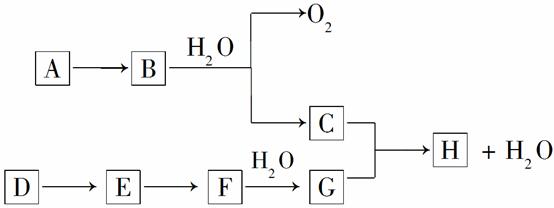
⑵E元素的电离能情况如图1所示。E元素在周期表中位于 ; D元素单质形成的晶体晶胞类型属于 堆积。
⑶A、B两元素所形成的化合物甲是首屈一指的超硬新材料,其晶胞结构如图2所示,由此可知,化合物甲的晶体类型为 ,其硬度超过金刚石的原因是 。化合物甲的晶体中B原子的杂化方式为 。
⑷D、C两元素可形成的化合物乙。
①现证实化合物乙的晶体结构如图3所示,晶胞中D离子的配位数为 ;
②设D离子半径分别为a,C离子半径分别为b,则其晶体的空间利用率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com