
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
分析 A.热化学方程式的正反应是吸热反应则逆反应是放热反应;
B.热化学方程式的系数只能表示物质的量;
C.根据焓变符号来确定反应的吸放热情况;
D.物质具有的能量越低越稳定.
解答 解:A.该热化学方程式的正反应是吸热反应则逆反应是放热反应,即当lmol白磷转变成红磷时放出17kJ热量,故A正确;
B.热化学方程式的系数只能表示物质的量,当4mol红磷转变成白磷时吸收17kJ热量,故B错误;
C.4P(红磷s)→P4(白磷s);△H=+17kJ•mol-1,焓变大于零,确定反应为吸热反应,故C错误;
D.根据4P(红磷s)→P4(白磷s);△H=+17kJ•mol-1,则反应物的能量低于生成物的,所以红磷具有的能量低,即白磷稳定性比红磷答,故D正确;
故选AD.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确物质具有能量与稳定性的关系为解答关键,注意掌握热化学方程式的表示方法及意义,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
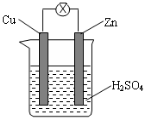
| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
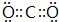 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式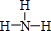 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com