
【题目】某溶液中存在大量的Ba2+、Ag+、NH4+,该溶液中还可能大量存在的离子是
A.OH- B.Cl- C.SO42- D.NO3-
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确
的是_________(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=______________________
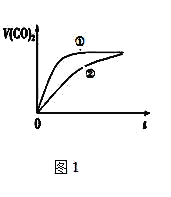
⑶常温下,将20mL 0.1 mol/L CH3COOH溶液 和20mL 0.1 mol/L HNO2 溶液分别与 20mL 0.1 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是_______(填写序号);反应结束后所得两溶液中,c(CH3COO-)________c(NO2-)(填“>”、“<”或“=”);
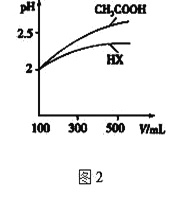
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数_________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A. 硫元素被氧化
B. 氧化剂与还原剂的物质的量之比为1:2
C. 每生成1molNa2S2O3,转移4mol电子
D. 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合下列条件的有机物中,同分异构体(不考虑立体异构)数目最多的是( )
A.分子式为C5H10且能使溴的CCl4溶液褪色
B.分子式为C7H16且含有三个甲基
C.分子式为C4H8O2且能与NaOH溶液反应
D.分子式为C4H10O且能与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A、 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B、常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1mol Cl2与足量NaOH溶液反应转移的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g)△H=-a kJmol-1。
2HI(g)△H=-a kJmol-1。
已知:

下列说法正确的是( )
A. 该反应为吸热反应
B. 断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ
C. 反应物的总能量低于生成物的总能量
D. 向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。下列分析错误的是( )

A. AB段的反应为Fe+2Fe3+===3Fe2+
B. 第二份溶液中最终溶质为FeSO4
C. 混合酸中NO![]() 物质的量为0.4 mol
物质的量为0.4 mol
D. 混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com