
下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(7)小题按题目要求回答。
族
周期 I A Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A O
1 A
2 D E G I
3 B C F H
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和E组成化合物类型 (填“离子化合物”或“共价化合物”);它比A和F组成化合物的沸点 (填“高”或“低”),原因是
(6)用电子式表示B的最高价氧化物对应的水化物的形成过程
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
(15分)(1)Ne F F2 Na ;(2)NaOH H2SO4 ;(3)HF; (4) Na;
(5)共价化合物,高,NH3中存在氢键(1~5各1分)
(6)(2分) 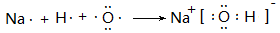
(7)(2分) Al2O3+2OH-===2AlO2-+H2O
【解析】
试题分析:根据元素周期周期表中的位置可知,A~I分别是H、Na、Al、C、N、P、F、Cl、Ne。
(1)根据元素周期律可知,表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na。
(2)非金属性或金属性越强,最高价氧化物的水化物的酸性或碱性越强,所以最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是H2SO4。
(3)非金属性越强,氢化物的稳定性越强,则A分别与D、E、F、G、H形成的化合物中,最稳定的HF。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以在B、C、E、F、G、H中,原子半径最大的是Na。
(5)A和E组成化合物是氨气,含有极性键,属于共价化合物。它比A和F组成化合物的沸点高,原因是NH3中存在氢键。
(6) B的最高价氧化物对应的水化物是氢氧化钠,则用电子式表示的形成过程是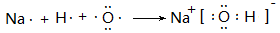 。
。
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式是Al2O3+2OH-===2AlO2-+H2O。
考点:考查元素周期表的结构、元素周期律的应用
点评:该题是高考中的常见考点,属于基础性试题的考查。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||


查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省嘉兴市八校联考高一(下)期中化学试卷(解析版) 题型:填空题
| 族周期 | IA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com