
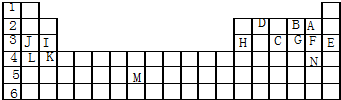
分析 (1)元素周期表中,化学性质最活泼的金属在左下角,化学性质越活泼则金属性越强,非金属性最强的在右上角,溴单质在常温下是液体,M属于过渡元素;
(2)根据元素的化合价确定化学式;
(3)同周期元素原子半径从左到右逐渐减小.
解答 解:根据元素周期表中元素的分布知识,可以知道:A是F,B是O,C是P,D是C,E是Ar,F是Cl,G是S,H是Al,I是Mg,J是Na,K是Ca,L是K,N是Br,M是Tc,M处于d区,属于过渡元素;
(1)元素周期表中,从上到下金属的活泼性逐渐增强,从右到左金属活泼性逐渐增强,所以化学性质最活泼的金属在左下角,应该是K,化学性质越活泼则金属性越强,所以金属性最强的也是K,稀有气体元素化学性质是最稳定的,即Ar化学性质是最稳定,元素周期表中,从下到上元素的非金属性逐渐增强,从左到右非金属性逐渐增强,所以非金属性最强的在右上角,应该是F,溴单质在常温下是液体,属于过渡元素的是M,故答案为:Ar;K;F;Br;M;
(2)根据元素的化合价确定化学式,B、F、C气态氢化物中O、Cl、P的化合价分别为-2、-1、-3,H的化合价为+1,所以它们的化学式分别为H2O、HCl、PH3,故答案为:H2O、HCl、PH3;
(3)同周期元素原子半径从左到右逐渐减小,所以原子半径最小的是Cl,故答案为:Cl.
点评 本题考查了元素周期表和元素周期律的综合应用,熟悉元素在周期表中的位置是解本题关键,注意周期律的灵活运用,难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,氨的溶解度不大 | B. | 氨水中的NH3•H2O电离出少量OH- | ||
| C. | 溶于水的氨分子只有少量电离 | D. | 氨本身的弱碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
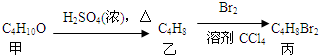 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| B. | 在一定条件下苯与氢气反应制环己烷 | |
| C. | 苯与浓硫酸共热制取苯磺酸 | |
| D. | 催化剂存在下,苯与溴反应制溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液 | B. | 新制Cu(OH)2悬浊液 | C. | KMnO4(H+)溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AD盐溶液pH>7 | B. | 在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) | ||
| C. | 酸的电离程度一定是:HD>HC | D. | 碱的电离程度一定是:AOH>BOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>H2S>SiH4 | B. | 原子半径:Na>N>Al | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:NaOH>Be(OH)2>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl | |
| B. | NCl3跟水发生复分解反应的初级产物是NH3和HClO | |
| C. | NCl3发生水解反应生成NH4Cl、O2和Cl2 | |
| D. | NCl3的电子式应表示为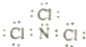 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com