
| A. | 在一定条件下,使煤和氢气作用,可以得到液体燃料,也可以获得洁净的燃料油 | |
| B. | (CH3)2CHCH(CH3)2的系统命名为:2,3-二甲基丁烷 | |
| C. | 硬脂酸甘油酯可以在稀硫酸中水解,也可以在NaOH溶液中发生皂化反应彻底水解 | |
| D. | 氨基酸分子中均含有氨基和羧基,加入浓的硫酸钠溶液可从溶液中析出 |
分析 A、在一定条件下将煤与氢气转化为液体燃料是煤的液化;
B、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上的碳原子编号;
C、酯类在酸性条件下的水解是可逆的,在碱性条件下的水解不可逆;
D、氨基酸没有盐析的性质.
解答 解:A、在一定条件下将煤与氢气转化为液体燃料是煤的液化,可以获得燃料油,在燃烧时不产生污染性气体,故A正确;
B、烷烃命名时,要选最长的碳链为主链,故主链上有4个碳原子,从离支链近的一端给主链上的碳原子编号,在2号和3号碳原子上各有1个甲基,故名称为:2,3-二甲基丁烷,故B正确;
C、油脂在酸性条件下的水解是可逆的,在碱性条件下的水解不可逆,且能制得肥皂的主要成分硬质酸钠,故称为造化反应,故C正确;
D、在加入浓的硫酸钠溶液可从溶液中析出的是蛋白质,氨基酸没有盐析的性质,故D错误.
故选D.
点评 本题考查了煤的综合利用、有机物的命名以及蛋白质的盐析等内容,属于基础性知识的考查,难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
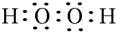 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
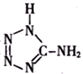 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、二氧化硫和干冰都属氧化物 | B. | H2SO4、HNO3和H2CO3都属于酸 | ||
| C. | KNO3、CuSO4和NH4Cl都属于盐 | D. | 烧碱、纯碱、熟石灰都属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极区域的现象:先生成白色沉淀后逐渐溶解 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 84g NaHCO3 溶于1L水配得1mol•L-1 NaHCO3 溶液 | |
| B. | 在标准状况下,44.8L HCl溶于1L水配成2mol•L-1 的盐酸溶液 | |
| C. | 在标准状况下,22.4L NH3溶于水配成1L溶液,浓度为1mol•L-1 | |
| D. | 1mol•L-1 的CaCl2溶液溶液1L,取出100mL,含0.2mol Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com