
����Ŀ��һ���¶��£���2L���ܱ������г���2molPCl3��g����1molCl2��g����������Ӧ��PCl3��g��+Cl2��g��PCl5��g����5min��ƽ�⣬�����е�ѹǿΪ��ʼʱ�� ![]() �����ҷų�37.2kJ����������ش��������⣺
�����ҷų�37.2kJ����������ش��������⣺
��1��ǰ5min�ڣ�v��Cl2��=molL��1min�����¶��£�ƽ�ⳣ��K= ��
��2�������ĸ�ͼ������ȷ˵��������Ӧ�ڽ��е�t1ʱ��ʱ���ﵽƽ��״̬ �� 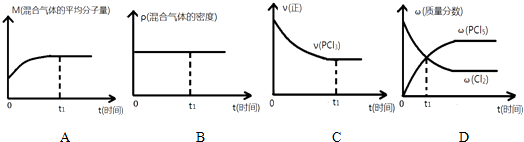
��3��ƽ�������������0.4molPCl3 �� 0.2molCl2��0.2molPCl5 �� ��ƽ����������ƶ����������ƶ������ƶ�������c��PCl3�����������С�����䡱����
��4����ͬ�����£�����ʼʱ����2L���ܱ������г���1molPCl3��g����1molPCl5��g������Ӧ��ƽ������������� kJ��������
��5��PCl5��������ˮ����ȫ��Ӧ����H3PO4��HCl������Ӧ��Ļ��Һ��μ��뵽������Na2CO3��Һ�У���д�����ܷ�����Ӧ�����ӷ���ʽ �� ����֪��H3PO4�ĵ���ƽ�ⳣ����Ka1=7.52��10��3 �� Ka2=6.23��10��8 �� Ka3=2.2��10��13��H2CO3�ĵ���ƽ�ⳣ����Ka1=4.3��10��7 �� Ka2=5.61��10��11��
���𰸡�
��1��0.04��0.83
��2��AC
��3�����ƶ�����С
��4��55.8
��5��H++CO32��=HCO3����H3PO4+2CO32��=HPO42��+2HCO3��
���������⣺��1����ƽ��ʱ�μӷ�Ӧ������Ϊxmol����
PCl3��g��+Cl2��g��PCl5��g��
��ʼ����mol����2 1 0
�仯����mol����x x x
ƽ������mol����2��x 1��x x
���º����£�ѹǿ֮�ȵ������ʵ���֮�ȣ��� ![]() =
= ![]() �����x=0.4����v��Cl2��=
�����x=0.4����v��Cl2��= ![]() =0.04mol/��L��min����ƽ�ⳣ��K=
=0.04mol/��L��min����ƽ�ⳣ��K= ![]() =
=  =
= ![]() =0.83�����Դ��ǣ�0.04��0.83����2��A������������������䣬�淴Ӧ���������ʵ�����С��ƽ����Է���������С�������淴Ӧ����ƽ����Է�������������ƽ����Է�����������˵������ƽ�⣬��A��ȷ�� B������������������䣬�������ݻ����䣬�ܶ�ʼ�ղ��䣬��B���� C���淴Ӧ���У�����Ӧ���ʼ��ͣ���Ӧ���ʲ��ٱ仯��˵������ƽ�⣬��C��ȷ�� D��t1ʱ�̺�PCl5��������������Cl2����������С��˵��t1ʱ��ʱ��Ӧ������Ӧ���У���D����ѡ��AC����3��ƽ�������������0.4molPCl3 �� 0.2molCl2��0.2molPCl5 �� Ũ����Qc=
=0.83�����Դ��ǣ�0.04��0.83����2��A������������������䣬�淴Ӧ���������ʵ�����С��ƽ����Է���������С�������淴Ӧ����ƽ����Է�������������ƽ����Է�����������˵������ƽ�⣬��A��ȷ�� B������������������䣬�������ݻ����䣬�ܶ�ʼ�ղ��䣬��B���� C���淴Ӧ���У�����Ӧ���ʼ��ͣ���Ӧ���ʲ��ٱ仯��˵������ƽ�⣬��C��ȷ�� D��t1ʱ�̺�PCl5��������������Cl2����������С��˵��t1ʱ��ʱ��Ӧ������Ӧ���У���D����ѡ��AC����3��ƽ�������������0.4molPCl3 �� 0.2molCl2��0.2molPCl5 �� Ũ����Qc=  =0.83=K��ƽ�ⲻ�ƶ���c��PCl3����С��
=0.83=K��ƽ�ⲻ�ƶ���c��PCl3����С��
���Դ��ǣ����ƶ�����С����4����ƽ��ʱ��Ӧ��PCl5��g��Ϊymol����
PCl3��g��+Cl2��g��PCl5��g��
��ʼ����mol����1 0 1
�仯����mol����y y y
ƽ������mol����1+y y 1��y
�� ![]() =
= ![]() �����y=0.6���ɣ�1���м����֪0.4mol������Ӧ�ų�37.2kJ��������������0.6mol�������յ�����Ϊ37.2kJ��
�����y=0.6���ɣ�1���м����֪0.4mol������Ӧ�ų�37.2kJ��������������0.6mol�������յ�����Ϊ37.2kJ�� ![]() =55.8kJ�����Դ��ǣ�55.8kJ����5��̼���������������ᷴӦ�����Ȼ�����̼�����ƣ���Ӧ���ӷ���ʽΪ��H++CO32��=HCO3���������ᡢ̼��ĵ���ƽ�ⳣ����֪������H3PO4��H2CO3��H2PO4����HCO3����HPO42�� �� ̼���������������ᷴӦ����̼�����ơ�Na2HPO4 �� ��Ӧ���ӷ���ʽΪ��H3PO4+2CO32��=HPO42��+2HCO3�� �� ���Դ��ǣ�H++CO32��=HCO3����H3PO4+2CO32��=HPO42��+2HCO3�� ��
=55.8kJ�����Դ��ǣ�55.8kJ����5��̼���������������ᷴӦ�����Ȼ�����̼�����ƣ���Ӧ���ӷ���ʽΪ��H++CO32��=HCO3���������ᡢ̼��ĵ���ƽ�ⳣ����֪������H3PO4��H2CO3��H2PO4����HCO3����HPO42�� �� ̼���������������ᷴӦ����̼�����ơ�Na2HPO4 �� ��Ӧ���ӷ���ʽΪ��H3PO4+2CO32��=HPO42��+2HCO3�� �� ���Դ��ǣ�H++CO32��=HCO3����H3PO4+2CO32��=HPO42��+2HCO3�� ��
�����㾫�������ջ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�ش����⣺
��1��������FeS2�������������ұ����������Ҫԭ�ϣ�����һ����ӦΪ3FeS2+8O2�T6SO2+Fe3O4 �� ��������Ϊ �� ����3molFeS2�μӷ�Ӧ��ת��mol���ӣ�
��2�����������ƣ�������Ҳ��������ˮ������ԭ��Ϊ�������ӷ��̱�ʾ��
��3��FeCl3������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ
��4�����ȵ�ϡ������Һ���ܽ�һ������FeSO4���ټ���������KNO3��Һ����ʹ���е�Fe2+ȫ��ת����Fe3+ �� ���������ݳ�����д����Ӧ�����ӷ���ʽ��
��5��������һ�ֺ�ɫ���ϣ���ɷ���Fe2O3��һ��������������160mL5molL��1�����У��ڼ���һ��������ǡ���ܽ⣬�ռ���2.24L����״����������⣬��ҹ����Fe3+ �� ��μӷ�Ӧ�����۵�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����(����)
A. SO2ͨ������KMnO4��Һ����ɫ��2MnO4-+4H++5SO22Mn2++5S +2H2O
B. �Ȼ�����Һ�м��������ˮ��Al3++4OH-AlO2+2H2O
C. NH4HSO3��Һ��������NaOH��Һ��ϼ�����NH4++HSO3- +2OH-![]() NH3��+SO32+2H2O
NH3��+SO32+2H2O
D. ���������Һ��ͨ�����������̼��Ca2++2ClO-+H2O+CO2CaCO3��+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ�У���ȷ���ǣ� ��
A.H2S2H++S2��
B.NaHCO3�TNa++H++CO32��
C.NaCl�TNa++Cl��
D.CH3COOH�TCH3COO��+H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���飨As���㷺�ֲ�����Ȼ�磬��ԭ�ӽṹʾ��ͼ�� ![]() ��
��
��1����λ��Ԫ�����ڱ����壬����̬�⻯����ȶ��Ա�NH3���ǿ������������
��2����ij�����������As2O3��As2O5 �� ����As2O5���ȶ��Բ����ͼ1д��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ�� �� 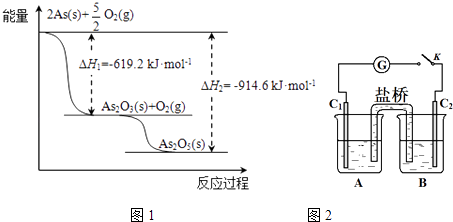
��3�������οɷ������·�Ӧ��AsO43��+2I��+2HAsO33��+I2+H2O��ͼ2װ���У�C1��C2��ʯī�缫
��A��ʢ����ɫ��KI��I2�Ļ����Һ��B��ʢ����ɫ��Na3AsO4��Na3AsO3�Ļ����Һ�������ӿ���K������B�еμ�Ũ����ʱ��������������G��ָ������ƫת����ʱC2�Ϸ����ĵ缫��Ӧ�� ��
��һ��ʱ���������ָ��ص��м䡰0��λʱ������B�еμӹ���ŨNaOH��Һ���ɹ۲쵽������ָ�������������������ƫ��������ƫ������
��4�����ã�3���з�Ӧ�ɲⶨ��As2O3��As2O5�������еĸ���ֺ������������ʶԲⶨ��Ӱ�죩���������£�
�ٽ���������NaOH��Һ���õ���AsO43����AsO33���Ļ����Һ��
As2O5��NaOH��Һ��Ӧ�����ӷ���ʽ�� ��
���������Һ��0.02500molL��1��I2��Һ�ζ�������I2��Һ20.00mL���ζ���Ϻ�ʹ��Һ�����ԣ����������KI��������I2����0.1000molL��1��Na2S2O3��Һ�ζ�������Na2S2O3��Һ30.00mL������֪2Na2S2O3+I2=Na2S4O6+2NaI��������As2O5�������� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ���ö����ЧӦ�����ֵ�������Һ����������Һ
B. ����������Һʱ������Ͳ�м���һ�������ˮ���ٱ߽������������Ũ����
C. �ں���1mol Fe��OH��3�Ľ����У���NA��Fe��OH��3����
D. ����ĵ�Ӿʵ���֤��ijЩ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�ã���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd+2NiOOH+2H2O ![]() Cd��OH��2+2Ni��OH��2 �� �йظõ�ص�˵����ȷ���ǣ� ��
Cd��OH��2+2Ni��OH��2 �� �йظõ�ص�˵����ȷ���ǣ� ��
A.���ʱ������Ӧ��Ni��OH��2��e��+OH���TNiOOH+H2O
B.�������ǻ�ѧ��ת��Ϊ���ܵĹ���
C.�ŵ�ʱ����������Һ�ļ��Բ���
D.�ŵ�ʱ�������Һ�е�OH���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڴ������������ʡ��ǵ���ʵ���ȷ���Ϊ
������ | ����� | ����� | �ǵ���� | |
A | �ƾ� | ��ˮ | ��ˮ | �ɱ� |
B | ����ˮ | ������Һ | �� | �������� |
C | ���� | ���� | ������ | CCl4 |
D | ���� | ʳ��ˮ | �Ȼ�ͭ | ̼���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Һ��Ϻ�,�ܷ������ӷ�Ӧ,����Һ�����������ᷢ���ı����( )
A.����ʯ��ˮ��ϡ������
B.С�մ���Һ�ʹ�����
C.��(���������ơ�̼�����ơ��Ȼ��ơ������)��Һ��BaCl2��Һ���
D.�Ȼ�����Һ������ˮ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com