
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
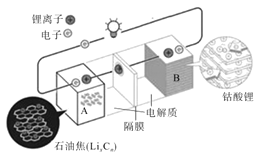
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,正极反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
【答案】D
【解析】
A. 汽车燃烧汽油等化石燃料,排放的汽车尾气含氮的氧化物,大量氮氧化物排放到空气中,在日光照射下二氧化氮能使氧气经过复杂的反应生成臭氧,臭氧与空气中的一些碳氢化合物发生作用后产生了一种有毒的烟雾,就是光化学烟雾,电动汽车可有效减少光化学烟雾污染,A正确;
B.可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC,则放电时正极反应为Li(1-x)CoO2+xLi++xe-= LiCoO2,充电时,原电池的正极即为电解池的阳极,反应逆转,则反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+,B正确;
C. 由图知,A电极为原电池的负极,B电极为原电池的正极,放电时,Li+由A极移向B极,C正确;
D. 若初始两电极质量相等,当转移2NA个电子时,负极减少2molLi其质量为14g,正极有2molLi+迁入,其质量为14g,两电极质量差为28g,D错误;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是8种有机化合物的转换关系:
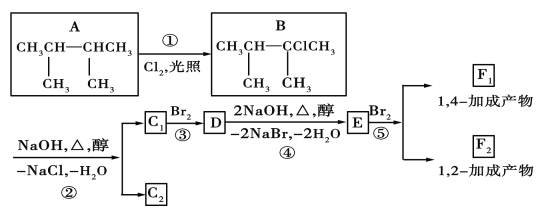
请回答下列问题:
(1)化合物E中含有的官能团的名称为___。
(2)上述框图中,①是___反应,③是___反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___。
(4)C1的结构简式是___;F1的结构简式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol/L的盐酸时,下列说法正确的是( )
A.AgCl沉淀溶解平衡向溶解方向移动B.AgCl的Ksp增大
C.溶液中c(Cl-)增大D.溶液中c(Ag+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
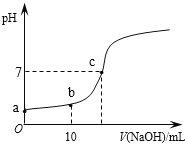
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_______。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=____。
②CO的平衡转化率α=_______。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:
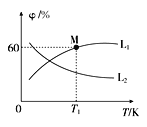
①能表示CO2的平衡体积分数与温度关系的曲线为____(填“L1”或“L2”),理由为_______。
②温度为T1时,该反应的平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如图:
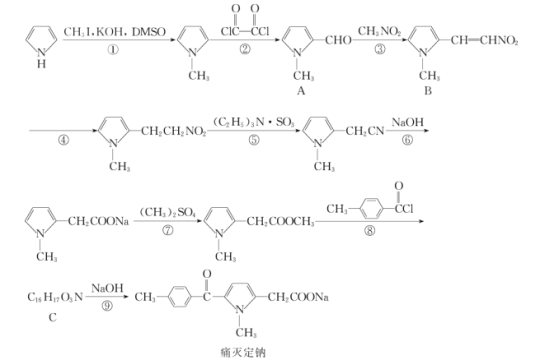
回答下列问题:
(1)化合物B中含有官能团的名称是__。
(2)化学反应①和④的反应类型分别为__和__。
(3)化合物C的结构简式为__。
(4)下列关于痛灭定钠的说法错误的是__。
a.与溴充分加成后官能团种类数不变
b.能够发生水解反应
c.核磁共振氢谱分析能够显示6个峰
d.可使溴的四氯化碳溶液褪色
e.1mol痛灭定钠与氢气加成最多消耗3molH2
(5)反应⑦的化学方程式为__。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:__(不考虑立体异构)。
(7)根据该试题提供的相关信息,写出由化合物![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图。__。
的合成路线图。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.氢氧化铁溶于盐酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.用惰性电极电解饱和食盐水:2Cl- + 2H2O![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
C.过氧化钠投入重水中:2Na2O2 + 2D2O = 4Na+ + O2↑+ 4OD-
D.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
【1】为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的质量数为( )
Md的质量数为( )
A.101B.157C.258D.359
【2】Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )
A.质子数B.电子层数C.核外电子数D.最外层电子数
【3】判断Cl的非金属性比S的强,可依据的事实是( )
A.HCl的热稳定性比H2S的强B.氯气能溶于水,硫难溶于水
C.常温下,氯单质呈气态,硫单质呈固态D.AgCl是白色固体,Ag2S是黑色固体
【4】锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A.最高化合价为+2B.原子半径比钠的大
C.单质与水的反应比钠更剧烈D.最高价氧化物对应的水化物碱性比钠的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1 H2SO4洗涤Fe粉,其目的是____,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入____(写化学式)。
(2)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式____。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是____。
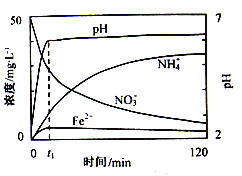
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:____;
假设三:____;
(4)请你设计实验验证上述假设一,补充实验步骤及结论:(已知:溶液中的NO3-浓度可用离子色谱仪测定)____、____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com