
| A. | NaHSO4溶液 | B. | NaCl溶液 | C. | KAl(SO4)2溶液 | D. | KF溶液 |
分析 水为弱电解质,水的电离平衡为:H2O?H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离;醋酸根离子水解促进了水的电离、氢氧化钠和氯化氢都抑制了水的电离,而氯化钠不影响水的电离平衡,据此进行解答.
解答 解:A、加入硫酸氢钠,硫酸氢钠电离出的氢离子抑制水的电离,水的电离平衡向逆向移动,故A错误;
B、加入氯化钠,氯离子和钠离子不水解,所以加入氯化钠不影响水的电离,故B正确;
C、加入硫酸铝钾,铝离子结合水电离出的氢氧根离子,促进水的电离,故C错误;
D、加入KF,氟离子结合水电离出的氢离子,促进水的电离,故D错误;
故选B.
点评 本题考查了影响水的电离的因素,题目难度不大,注意水的电离过程是吸热过程,升温促进电离,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
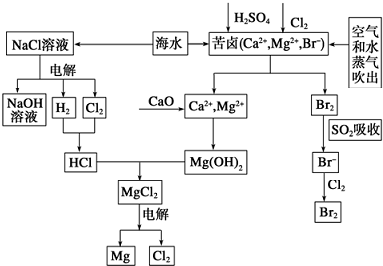
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 深蓝色的[Cu(NH3)4]SO4溶液中加入乙醇析出晶体 | 乙醇增强了溶剂的极性 |
| B | 用KSCN检验溶液中的Fe3+ | Fe3+遇SCN-生成血红色沉淀 |
| C | CH4熔点低于CO2 | 碳氢键比碳氧键的键长短、键能大 |
| D | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
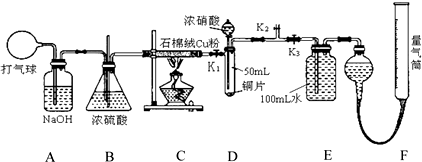
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
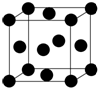 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com