
| A. | 1mol乙基中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
分析 A.乙基结构简式-CH2CH3,1个乙基含有17个电子;
B.1个甲烷含有10个电子;
C.标况下,氯仿为液体;
D.乙烯、丙烯和丁烯的最简式均为CH2.
解答 解:A.乙基结构简式-CH2CH3,1个乙基含有17个电子,则1mol乙基中含有的电子数为17NA,故A错误;
B.8g CH4中物质的量为$\frac{8g}{16g/mol}$=0.5mol,含有电子数0.5mol×10=5mol,个数为5NA个,故B错误;
C.标况下,氯仿为液体,不能使用气体摩尔体积,故C错误;
D.乙烯、丙烯和丁烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为n=$\frac{28g}{14g/mol}$=2mol,则含有的碳原子为2NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关应用与计算,掌握公式的使用和物质的结构,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
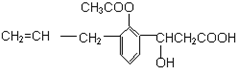
| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | B. | 用食醋可除去热水壶内壁的水垢 | ||
| C. | 烹鱼时加适量醋和酒可以增加香味 | D. | 乙烯可作为水果的催熟剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、天然气和石油是纯净物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键吸收的能量大于形成化学键所放出的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向水中加少量稀盐酸 | B. | 将纯水加热到100℃ | ||
| C. | 常温下,向水中加少量Na | D. | 常温下,向水中加少量Na2CO3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com