
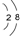
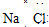
2 1 |
6 3 |
7 3 |
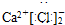
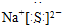
2 1 |
6 3 |
7 3 |
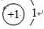 ,故A错误;
,故A错误;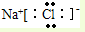 ,故B错误;
,故B错误;2 1 |
2 1 |
6 3 |
7 3 |
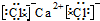 ,故E错误;
,故E错误; ,故F正确;
,故F正确; ,
, ;
;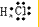 ,
,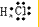 ;
;

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、一定不存在Ba2+,NH4+可能存在 |
| B、一定不存在Cl- |
| C、一定存在Na+ |
| D、可能存在Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、①③⑥ | C、②④ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
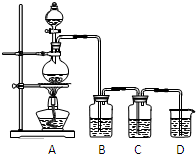 已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
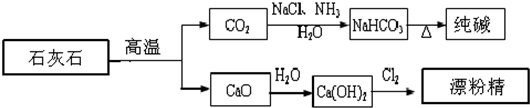
| A、漂粉精是混合物,主要成分是氯化钙 |
| B、图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2 |
| C、纯碱属于碱,俗名苏打 |
| D、制取纯碱和漂粉精所涉及的反应都是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com